
【題目】氯是海水中含量最豐富的元素,氯的單質及其化合物在生成、生活領域應用廣泛。
(1)自來水廠常用液氯進行殺菌消毒。氯氣溶于水發生的可逆反應為______________(用離子方程式表示)。
(2)用液氯消毒會產生微量有機氯代物,危害人體健康,可以使用二氧化氯(ClO2)代替液氯。工業上以黃鐵礦(FeS2)、氯酸鈉(NaClO3)和硫酸溶液混合制備二氧化氯氣體。已知黃鐵礦中的硫元素(-1價)最終氧化成SO42-,寫出制備二氧化氯的離子方程式_____________________________________。
(3)生產漂白粉工廠的主要設備是氯化塔,塔從上到下分為四層,如圖為生產流程示意圖。
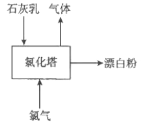
生產漂白粉反應的化學方程式為_____________________。實際生產中,將石灰乳(含有3%-6%水分的熟石灰)從塔頂噴灑而下,氯氣從塔的最底層通入。這樣加料的目的是_____________________________。
(4)用莫爾法可以測定溶液中Cl-的含量。莫爾法是一種沉淀滴定法,用標準AgNO3溶液滴定待測液,以K2CrO4為指示劑,滴定終點的現象是溶液中出現磚紅色沉淀(Ag2CrO4)。已知平衡Cr2O72-+H2O![]() 2CrO42-+2H+,該滴定過程需要控制pH范圍在6.5~10.5,若pH小于6.5會使測定結果偏高。結合平衡移動原理解釋偏高的原因:_______________________________ 。
2CrO42-+2H+,該滴定過程需要控制pH范圍在6.5~10.5,若pH小于6.5會使測定結果偏高。結合平衡移動原理解釋偏高的原因:_______________________________ 。
【答案】Cl2+H2O![]() H++Cl-+HClO 15ClO3-+FeS2+14H+=15ClO2+Fe3++2SO42-+7H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 促進反應物間的充分接觸,提高反應的效率 提高氫離子濃度,平衡逆向移動,CrO42-濃度降低,導致生成的Ag2CrO4(磚紅色)沉淀所需銀離子濃度增大,消耗的硝酸銀量增多,使測得的氯離子含量偏高
H++Cl-+HClO 15ClO3-+FeS2+14H+=15ClO2+Fe3++2SO42-+7H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 促進反應物間的充分接觸,提高反應的效率 提高氫離子濃度,平衡逆向移動,CrO42-濃度降低,導致生成的Ag2CrO4(磚紅色)沉淀所需銀離子濃度增大,消耗的硝酸銀量增多,使測得的氯離子含量偏高
【解析】
(1)氯氣與水的反應為:Cl2+H2O![]() HCl+HClO,改寫成離子方程式即可解答;
HCl+HClO,改寫成離子方程式即可解答;
(2)由題給信息可知該反應的氧化劑為NaClO3,還原劑為FeS2,氧化產物為SO42-和Fe3+,還原產物為ClO2,根據氧化還原反應方程式的配平方法解答;
(3)氯氣與石灰乳的反應方程式為:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,工業上工藝條件的選擇往往從提高產率和提高效率兩個方面進行分析,由此可得結論。
(4)若溶液的pH減小,則氫離子濃度增大,導致平衡Cr2O72-+H2O![]() 2CrO42-+2H+逆向移動,溶液中CrO42-濃度偏小,由Ag2CrO4的溶度積可得生成的Ag2CrO4(磚紅色)沉淀所需銀離子濃度增大,消耗的硝酸銀的量增多,從而使測得的氯離子含量偏高,據此分析可得結論。
2CrO42-+2H+逆向移動,溶液中CrO42-濃度偏小,由Ag2CrO4的溶度積可得生成的Ag2CrO4(磚紅色)沉淀所需銀離子濃度增大,消耗的硝酸銀的量增多,從而使測得的氯離子含量偏高,據此分析可得結論。
(1)氯氣溶于水,其中部分氯氣與水反應生成HCl和HClO,次氯酸為弱酸,溶液中主要以分子形式存在,故答案為:Cl2+H2O![]() H++Cl-+HClO;
H++Cl-+HClO;
(2)由題給信息可知該反應的氧化劑為NaClO3,還原劑為FeS2,氧化產物為SO42-和Fe3+,還原產物為ClO2,根據氧化還原反應規律可得反應的離子方程式為:15ClO3-+FeS2+14H+=15ClO2+Fe3++2SO42-+7H2O,故答案為:15ClO3-+FeS2+14H+=15ClO2+Fe3++2SO42-+7H2O;
(3)氯氣與石灰乳反應生成氯化鈣、次氯酸鈣和水,化學方程式為:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,工業上通常采取逆流工藝[將石灰乳(含有3%-6%水分的熟石灰)從塔頂噴灑而下,氯氣從塔的最底層通入]來促進反應物間的充分接觸,提高反應的效率,故答案為:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;促進反應物間的充分接觸,提高反應的效率;
(4)若溶液的pH小于6.5,則氫離子濃度增大,導致平衡Cr2O72-+H2O![]() 2CrO42-+2H+逆向移動,溶液中CrO42-濃度偏小,由Ag2CrO4的溶度積可得生成的Ag2CrO4(磚紅色)沉淀所需銀離子濃度增大,消耗的硝酸銀的量增多,從而使測得的氯離子含量偏高,故答案為:提高氫離子濃度,平衡逆向移動,CrO42-濃度降低,導致生成的Ag2CrO4(磚紅色)沉淀所需銀離子濃度增大,消耗硝酸銀的量增多,使測得的氯離子含量偏高。
2CrO42-+2H+逆向移動,溶液中CrO42-濃度偏小,由Ag2CrO4的溶度積可得生成的Ag2CrO4(磚紅色)沉淀所需銀離子濃度增大,消耗的硝酸銀的量增多,從而使測得的氯離子含量偏高,故答案為:提高氫離子濃度,平衡逆向移動,CrO42-濃度降低,導致生成的Ag2CrO4(磚紅色)沉淀所需銀離子濃度增大,消耗硝酸銀的量增多,使測得的氯離子含量偏高。


科目:高中化學 來源: 題型:
【題目】某燒堿樣品含少量不與酸作用的雜質,為了測定其純度,進行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL燒堿溶液
B.用移液管移取25 mL燒堿溶液于錐形瓶中并滴幾滴甲基橙指示劑
C.在天平上準確稱取燒堿樣品W g,在燒杯中用蒸餾水溶解
D.將物質的量濃度為c的標準硫酸溶液裝入酸式滴定管,調節液面,記下開始讀數為V1
E.在錐形瓶下墊一張白紙,滴定至終點,記下讀數V2
回答下列各問題:
(1)正確操作步驟的順序是________ →________ →________ →D→________(均用字母填寫)。
(2)滴定管的讀數應注意_________________________________。
(3)E中在錐形瓶下墊一張白紙的作用是____________________。
(4)D步驟中液面應調節到____________________,尖嘴部分應__________________。
(5)滴定終點時錐形瓶內溶液的pH約為________,終點時顏色變化是_____________________________________________________。
(6)若酸式滴定管不用標準硫酸潤洗,在其他操作均正確的前提下,會對測定結果(指燒堿的純度)有何影響?________(填“偏高”“偏低”或“不變”)。
(7)該燒堿樣品純度的計算式為___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將甘油(C3H8O3)轉化為高附值產品是當前熱點研究方向,如甘油和水蒸氣、氧氣經催化重整或部分催化氧化可制得氫氣,反應主要過程如下:

(1)下列說法正確的是______(填字母序號)。
a.消耗等量的甘油,反應I的產氫率最高
b.消耗等量的甘油,反應II的放熱最顯著
c.經過計算得到反應III的H3=-237.5 kJ/mol,
d.理論上,通過調控甘油、水蒸氣、氧氣的用量比例可以實現自熱重整反應,即焓變約為0,這體現了科研工作者對吸熱和放熱反應的聯合應用
(2)研究人員經過反復試驗,實際生產中將反應III設定在較高溫度(600~700°C)進行,選擇該溫度范圍的原因有:催化劑活性和選擇性高、____________。
(3)研究人員發現,反應I的副產物很多,主要含有:CH4、C2H4、CO、CO2、CH3CHO、CH3COOH等,為了顯著提高氫氣的產率,采取以下兩個措施。
①首要抑制產生甲烷的副反應。從原子利用率角度分析其原因:__________________。
②用CaO吸附增強制氫。如圖1所示,請解釋加入CaO的原因:____________________。
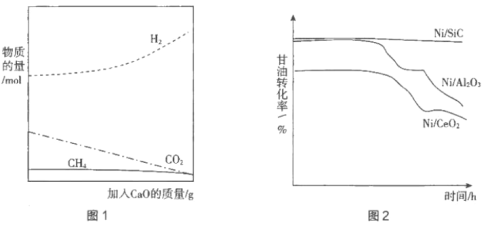
(4)制備高效的催化劑是這種制氫方法能大規模應用于工業的重要因素。通常將Ni分散在高比表面的載體(SiC、Al2O3、CeO2)上以提高催化效率。分別用三種催化劑進行實驗,持續通入原料氣,在一段時間內多次取樣,繪制甘油轉化率與時間的關系如圖2所示。
①結合圖2分析Ni/SiC催化劑具有的優點是____________________。
②研究發現造成催化效率隨時間下降的主要原因是副反應產生的大量碳粉(積碳)包裹催化劑,通過加入微量的、可循環利用的氧化鑭(La2O3)可有效減少積碳。其反應機理包括兩步:
第一步為:La2O3+CO2 ![]() La2O2CO3
La2O2CO3
第二步為:______________________________(寫出化學反應方程式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對可逆反應4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列敘述中正確的是
4NO(g)+6H2O(g),下列敘述中正確的是
A. 達到化學平衡時4v正(O2)=5v逆(NO)
B. 若單位時間內生成x mol NO的同時,消耗x mol NH3,則反應達到平衡狀態
C. 達到化學平衡時,若增大容器的體積,則正反應速率減小,逆反應速率增大
D. 化學反應速率的關系是2v逆(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】草酸(H2C2O4)是二元弱酸(K1=5.9×10-2、K2=6.4×10-5)。向10mL稀H2C2O4溶液中滴加等濃度NaOH溶液,H2C2O4、HC2O4—、C2O42—的濃度分數δ隨溶液pH變化的關系如圖,以下說法正確的是( )
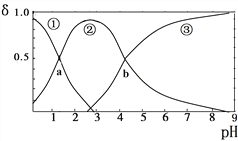
A. HC2O4—的濃度分數隨pH增大而增大
B. 交點a處對應加入的NaOH溶液的體積為5mL
C. 交點b處c(H+)=6.4×10-5
D. pH=5時存在c(Na+)+c(H+)=c(C2O42—)+c(HC2O4—)+c(OH—)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com