
【題目】(1)金屬鎳及其化合物在合金材料以及催化劑等方面應用廣泛。請回答下列問題:
①NiO、FeO的晶體結構類型均與氯化鈉的相同,Ni2+和Fe2+的離子半徑分別為69pm和78pm,則熔點FeO________NiO(填“<”或“>”);
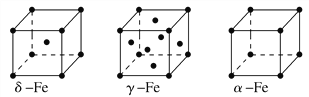
②鐵有δ、γ、α三種同素異形體,各晶胞如下圖,則δ、α兩種晶胞中鐵原子的配位數之比為________。
(2)元素金(Au)處于周期表中的第六周期,與Cu同族,一種銅金合金晶體具有立方最密堆積的結構,在晶胞中Cu原子處于面心,Au原子處于頂點位置,則該合金中Cu原子與Au原子數量之比為________;該晶體中,原子之間的強相互作用是________。
(3)某鈣鈦型復合氧化物如圖1所示,以A原子為晶胞的頂點,A位可以是Ca、Sr、Ba或Pb,當B位是V、Cr、Mn、Fe等時,這種化合物具有CMR效應。
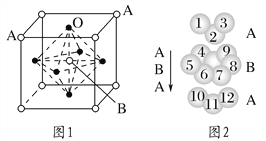
①用A、B、O表示這類特殊晶體的化學式:_________________________。
②已知La為+3價,當被鈣等二價元素A替代時,可形成復合鈣鈦礦化合物La1-xAxMnO3(x<0.1),此時一部分錳轉變為+4價。導致材料在某一溫度附近有反鐵磁-鐵磁、鐵磁-順磁及金屬-半導體的轉變,則La1-xAxMnO3中三價錳與四價錳的物質的量之比為________。
③下列有關說法正確的是________。
A.鑭、錳、氧分別位于周期表f、d、p區
B.氧的第一電離能比氮的第一電離能大
C.錳的電負性為1.59,Cr的電負性為1.66,說明錳的金屬性比鉻強
D.鉻的堆積方式與鉀相同,則其堆積方式如圖2所示
【答案】 < 4∶3 3∶1 金屬鍵 ABO3 ![]() AC
AC
【解析】本題主要考查晶體結構。
(1)①離子半徑越小,熔點越低,則熔點FeO<NiO;
②鐵的δ、α同素異形體晶胞中鐵原子的配位數分別是8和6,則δ、α兩種晶胞中鐵原子的配位數之比為4∶3。
(2)在晶胞中Cu原子處于面心,Au原子處于頂點位置,則該合金中Cu原子與Au原子數量之比為3∶1;該晶體中,原子之間的強相互作用是金屬鍵。
(3)①用A、B、O表示這類特殊晶體的化學式:ABO3。
②當有x個La被鈣等二價元素A替代時,就會有x個錳原子轉變為+4價,則La1-xAxMnO3中三價錳與四價錳的物質的量之比為![]() 。
。
③A.鑭、錳、氧的價電子分別是5d16s2、3d54s2、2s23p4,它們分別位于周期表f、d、p區,故A正確;B.氮原子2p電子半充滿,比較穩定,所以氧的第一電離能比氮的第一電離能小,故B錯誤;C.錳的電負性為1.59,Cr的電負性為1.66,說明錳的金屬性比鉻強,故C正確;D.如圖2所示堆積方式是A、B、C,鉀的堆積方式是A、B,故D錯誤。故選AC。


科目:高中化學 來源: 題型:
【題目】短周期主族元素X、Y、Z、W的原子序數依次增大,X、W同主族;Y、Z同周期;X、Y、Z三種元素形成一種化合物M,25 ℃時,0.1 molL-1的M溶液中 =1.0×10-12。下列說法正確的是
=1.0×10-12。下列說法正確的是
A. 簡單離子半徑:Y<Z<W
B. X分別與Z、W形成的化合物中,所含化學鍵類型相同
C. X、Y形成的最簡單化合物的電子式為![]()
D. Z分別與X、W均可形成具有漂白性的化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列示意圖中,白球代表氫原子,黑球代表氦原子,方框代表容器,容器中間有一個可以上下滑動的隔板(其質量忽略不計)。其中能表示等質量的氫氣與氦氣的是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中,正確的是
A. 工業上電解熔融的氯化鋁來制備鋁
B. Al2O3是耐高溫材料,可用于制耐火坩堝
C. 鋁表面有一層致密的氧化膜,使Al不能溶于稀硝酸
D. 鋁粉和MgO或MnO2粉末混合,在高溫下能發生鋁熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】小明因胃部不適去醫院檢查,醫生告之是由于“胃酸過多”引起,建議服用抑酸劑。下列藥物可作抑酸劑的是
A. 維生素C B. 阿司匹林
C. 復方氫氧化鋁片 D. 葡萄糖口服液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乳酸(![]() )是一種化合物,在多種生物化學中起作用。利用乳酸為原料,可以合成某芳香族功能高分子材料H,回答下列問題。
)是一種化合物,在多種生物化學中起作用。利用乳酸為原料,可以合成某芳香族功能高分子材料H,回答下列問題。

(1)下列關于乳酸的說法正確的是_________
A.乳酸屬于氨基酸 B. lmol乳酸能與2molNaOH反應
C.乳酸能溶于水 D.可以利用紅外光譜法鑒別乳酸與丙酸
(2)A→B的反應類型是______________,C→D的反應類型是__________________。
(3)化合物B的系統命名是_____________,化合物G的結構簡式是______________。
(4)某芳香族功能高分子材料H是由B、G發生反應合成的,寫出該過程的化學方程式:_________________________________________。
(5)某芳香化合物W是化合物F的同分異構體,W能發生銀鏡反應,且能發生水解反應,則W的結構有_______種,其中核磁共振氫譜峰數最少的結構簡式是_______________ (任寫一種)。
(6)布洛芬是一種常用藥物,主要成分的結構簡式是 。現以有機原料2-甲基丙烯和苯乙酮(
。現以有機原料2-甲基丙烯和苯乙酮( ),設計合成路線以制備
),設計合成路線以制備 ,無機試劑任用(已知R-X也可以發生類似C→D的反應)。
,無機試劑任用(已知R-X也可以發生類似C→D的反應)。
_______________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中錯誤的是
A.推廣使用新能源,可以減少二氧化碳等溫室氣體的排放
B.發電廠的燃煤在燃燒時加入適量石灰石,可減少二氧化硫排放
C.石油、煤、天然氣均屬于可再生的化石燃料
D.太陽能、氫能、風能屬于清潔能源
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】FeCO3與砂糖混用可作補血劑。以黃鐵礦燒渣(含CuO、Fe2O3、FeO、SiO2、Al2O3等)為主要原料制備FeCO3的流程如下:

(1)質量分數為30%(密度是1.176 g·cm-3)的稀硫酸的物質的量濃度為________。
(2)檢驗濾液A中存在Fe2+的試劑是________。
(3)加入足量鐵粉的作用除調節pH使Al3+轉化為Al(OH)3沉淀外,還有兩個作用,分別寫出這兩個反應的離子方程式:____________ , ________________。
(4)寫出濾液C與NH4HCO3溶液反應的離子方程式:_____________________。
(5)FeCO3在空氣中灼燒可制得鐵系氧化物材料。已知25 ℃,101 kPa時:
4Fe(s)+3O2(g)![]() 2Fe2O3(s)ΔH=-1 648 kJ·mol-1
2Fe2O3(s)ΔH=-1 648 kJ·mol-1
C(s)+O2(g)![]() CO2(g)ΔH=-393 kJ·mol-1
CO2(g)ΔH=-393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g)![]() 2FeCO3(s)ΔH=-1 480 kJ·mol-1
2FeCO3(s)ΔH=-1 480 kJ·mol-1
寫出FeCO3在空氣中灼燒生成Fe2O3的熱化學方程式:________。
(6)某興趣小組為充分利用副產品,欲利用濾渣D為原料制取Al2O3,請補充完成實驗步驟:向濾渣D中加入適量________溶液,_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】—種微生物燃枓電池如圖所示,下列關于該電池說法正確的是:

A. a電極為正極
B. H+由右室通過質子交換膜進入左室
C. a電極反應式為:C6H5OH-28e-+11H2O=6CO2↑+28H+
D. 當b電極上產生lmolN2時,溶液中將有l0mole-通過
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com