
【題目】研究含碳化合物的結構與性質,對生產、科研等具有重要意義
(1)冠醚是由多個二元醇分子之間失水形成的環狀化合物。X、Y、Z是常見的三種冠醚,其結構如圖所示。它們能與堿金屬離子作用,并且隨著環的大小不同而與不同金屬離子作用。

①Li+計與X的空腔大小相近,恰好能進入到X的環內,且Li+與氧原子的一對孤電子對作用形成穩定結構W(如圖)。
a.基態鋰離子核外能量最高的電子所處能層符號為___________;
b.W中Li+與孤對電子之間的作用屬于___________(選填字母標號)
A.離子鍵 B.共價鍵 C.配位鍵 D.氫鍵 E.以上都不是
②冠醚Y能與K+形成穩定結構,但不能與Li+計形成穩定結構。理由是___________。
③烯烴難溶于水,被KMnO4水溶液氧化的效果較差。若烯烴中溶人冠醚Z,氧化效果明顯提升。
i.水分子中氧的雜化軌道的空間構型是___________,H-O鍵鍵角___________(填“>”“<”或“=”)109°28′
ii.已知:冠醚Z與KMnO4可以發生右圖所示的變化。加入冠醚Z后,烯烴的氧化效果明顯提升的原因是___________。
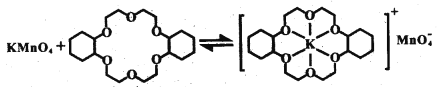
(2)甲烷是重要的清潔能源,其晶體結構如圖所示,晶胞參數為anm。
①常溫常壓下不存在甲烷晶體。從微粒間相互作用的角度解釋,其理由是___________;
②甲烷分子的配位數為___________;
③A分子中碳原子的坐標參數為(0,0,0),則B分子的碳原子的坐標參數為___________。
④甲烷晶體的密度為___________(g·cm-3)。

【答案】K C Li+半徑比Y的空腔小得多,不易與空腔內氧原子的孤電子對作用形成穩定結構 正四面體 小于 冠醚可溶于烯烴,進入冠醚中的K+因靜電作用將MnO4-帶入烯烴中,增大烯烴與MnO4-接觸機會,提升氧化效果。 甲烷是分子晶體,分子間作用力很小,熔沸點遠低于常溫。 12 (-0.5a,0.5a,a) 64×1021/(a NA)
【解析】
①a.基態鋰離子核外電子排布為1S2,所以核外能量最高的電子所處能層符號為K;
b.因為共用電子對由氧原子提供,與鋰離子共用,所以屬于配位鍵;
②根據Li+的半徑比K+的半徑小來回答;
③在水分子中,氧原子2s、2px、2py、2pz 4個原子軌道通過sp3雜化形成4個雜化軌道,所以水分子中氧的雜化軌道的空間構型為正四面體構型;但在其中有2對未共用的電子對(稱之為孤電子對)占據在兩個sp3雜化軌道中。孤電子對所占用的雜化軌道電子云比較密集,對成鍵電子對所占的雜化軌道起了推斥和壓縮的作用,以致兩個O-H鍵間夾角被壓縮成了104°45′,而不再是正四面體雜化的109°28′;
ii. 由相似相溶原理可知,冠醚可溶于烯烴,進入冠醚中的K+因靜電作用將MnO4-帶入烯烴中,增大烯烴與MnO4-接觸機會,提升氧化效果。
(2)①甲烷屬于分子晶體,微粒間存在分子間作用力進行分析;
②根據晶胞可以看出,甲烷的晶胞結構為面心立方,所以甲烷的配位數為12;
③A分子中碳原子的坐標參數為(0,0,0),則B分子的碳原子的坐標參數為(-0.5a,0.5a,a)
④算出晶胞中甲烷分子的質量,再除以晶胞體積;
①a.基態鋰離子核外電子排布為1S2,所以核外能量最高的電子所處能層符號為K;
正確答案:K。
b.因為共用電子對由氧原子提供,與鋰離子共用,所以屬于配位鍵;
正確答案:C。
②根據Li+的半徑比K+的半徑小來回答;
正確答案:Li+半徑比Y的空腔小得多,不易與空腔內氧原子的孤電子對作用形成穩定結構。
③在水分子中,氧原子2s、2px、2py、2pz4個原子軌道通過sp3雜化形成4個雜化軌道,所以水分子中氧的雜化軌道的空間構型為正四面體構型;但在其中有2對未共用的電子對(稱之為孤電子對)占據在兩個sp3雜化軌道中。孤電子對所占用的雜化軌道電子云比較密集,對成鍵電子對所占的雜化軌道起了排斥和壓縮的作用,以致兩個O-H鍵間夾角被壓縮成了104°45′,而不再是正四面體構型中的109°28′。
正確答案:正四面體 <
ii. 由相似相溶原理可知,冠醚可溶于烯烴,進入冠醚中的K+因靜電作用將MnO4-帶入烯烴中,增大烯烴與MnO4-接觸機會,提升氧化效果。
正確答案:冠醚可溶于烯烴,進入冠醚中的K+因靜電作用將MnO4-帶入烯烴中,增大烯烴與MnO4-接觸機會,提升氧化效果。
(2)①甲烷屬于分子晶體,微粒間是分子間作用力進行分析;
正確答案:甲烷是分子晶體,分子間作用力很小,熔沸點遠低于常溫。
②根據晶胞可以看出,甲烷的晶胞結構為面心立方,所以甲烷的配位數為12;
正確答案:12
③A分子中碳原子的坐標參數為(0,0,0),則B分子的碳原子的坐標參數為(-0.5a,0.5a,a)
正確答案:(-0.5a,0.5a,a)
④算出晶胞中甲烷分子的質量,再除以晶胞體積;
(1)晶胞中含有甲烷分子數為8×1/8+6×1/2=4個,質量為m(CH4)=![]() =64/NAg;(2)晶胞體積V=(a×10-7cm)3=a3×10-21cm3 。根據(1)(2)得到密度= m(CH4)/V=(64/NAg)/(a3×10-21cm3)=64×1021/(a3NA);
=64/NAg;(2)晶胞體積V=(a×10-7cm)3=a3×10-21cm3 。根據(1)(2)得到密度= m(CH4)/V=(64/NAg)/(a3×10-21cm3)=64×1021/(a3NA);
正確答案:64×1021/(a3NA)。


 提分百分百檢測卷單元期末測試卷系列答案
提分百分百檢測卷單元期末測試卷系列答案科目:高中化學 來源: 題型:
【題目】I.甲醛在木材加工、醫藥等方面有重要用途。甲醇直接脫氫是工業上合成甲醛的新方法,制備過程涉及的主要反應如下:
反應I:CH3OH(g)![]() HCHO(g)+H2(g) △H1=+85.2kJ/mol
HCHO(g)+H2(g) △H1=+85.2kJ/mol
反應II:CH3OH(g)+![]() O2(g)
O2(g)![]() HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2
反應III:2H2(g)+O2(g)![]() 2H2O(g) △H3=-483.6kJ/mol
2H2O(g) △H3=-483.6kJ/mol
(1)計算反應Ⅱ的反應熱△H2=_____________________________。
(2)750K下,在恒容密閉容器中,發生反應CH3OH(g)![]() HCHO(g)+H2(g),若起始壓強為P0,達到平衡轉化率為α,則平衡時的總壓強P平=___________(用含P0和α的式子表示);當P0=101kPa,測得α=50.0%,計算反應平衡常數Kp=___________kPa(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數,忽略其它反應)。
HCHO(g)+H2(g),若起始壓強為P0,達到平衡轉化率為α,則平衡時的總壓強P平=___________(用含P0和α的式子表示);當P0=101kPa,測得α=50.0%,計算反應平衡常數Kp=___________kPa(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數,忽略其它反應)。
II.CO2既是溫室氣體,也是重要的化工原料,以CO2為原料可合成多種有機物。
(3)CO2用于生產乙烯,已知:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) △H=QkJ/mol。一定條件下,按不同的投料比X[X=
CH2=CH2(g)+4H2O(g) △H=QkJ/mol。一定條件下,按不同的投料比X[X=![]() ]向某容積可變的恒壓密閉容器中充入CO2、H2,測得不同投料比時CO2的轉化率與溫度的關系如圖所示。
]向某容積可變的恒壓密閉容器中充入CO2、H2,測得不同投料比時CO2的轉化率與溫度的關系如圖所示。

①X1_____X2(填“>”或“<”,后同),Q_____0。
②圖中A、B、C三點對應的平衡常數KA、KB、KC的大小關系為_____。
(4)常溫下,用NaOH溶液作CO2捕捉劑不僅可以降低碳排放,而且可得到重要的化工產品Na2CO3。
①若某次捕捉后得到pH=10的溶液,則溶液中c(CO32-):c(HCO3-)=_____[常溫下K1(H2CO3)=4.4×10﹣7、K2(H2CO3)=5×10﹣11]。
②欲用5L Na2CO3溶液將23.3g BaSO4固體全都轉化為BaCO3,則所用的Na2CO3溶液的物質的量濃度至少為__________。[已知:常溫下Ksp(BaSO4)=1×10﹣7、Ksp(BaCO3)=2.5×10﹣6]。(忽略溶液體積積的變化)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗原理、裝置、操作或結論的描述,錯誤的是

A. 圖1所示裝置可實現甲烷與氯氣在光照條件下的取代反應
B. 圖2所示裝置可分離CH3COONa溶液和CH3COOC2H5的混合液
C. 圖3是原電池裝置,有明顯的電流
D. 圖4所示裝置可說明濃H2SO4具有脫水性、強氧化性,SO2具有漂白性、還原性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】物質分類和實驗探究都是中學化學重要的學科思想。
(一)以下是對“一些物質與水反應”的分類圖,請按要求填空:

上述分類方法是______;A組物質中屬于電解質的是_____(填化學式);C組物質與水反應的離子方程式為_____;D組物質與水反應中,氧化劑和還原劑物質的量之比為1∶2的物質是___(填化學式)。
(二)用質量分數為98%的濃硫酸(密度為1.84 g·cm3)配制240 mL濃度為0.5 mol·L-1的硫酸溶液,選用到的儀器正確的是______(填序號)。

下列操作會使配制結果偏高的是_______(填序號)
A 容量瓶用蒸餾水洗凈后,未進行干燥處理
B 稀釋的硫酸轉移到容量瓶中后未洗滌燒杯
C 未冷卻,即將溶液注入容量瓶并定容
D定容時,俯視容量瓶的刻度線
(三)某小組用如下裝置比較氯、溴、碘的非金屬性強弱實驗(夾持儀器已略去,氣密性已檢驗)。

實驗步驟:
①打開彈簧夾,打開活塞a,滴加濃鹽酸;
②當B和C中的溶液都變為黃色時,夾緊彈簧夾;
③當B中溶液由黃色變為棕紅色時,關閉活塞a;
④打開活塞b,將少量C中溶液滴入試管D中,關閉活塞b,取下試管D振蕩,靜置后CCl4層變為紫紅色。
請回答:
(1)裝置A中證明氯的非金屬性強于碘的實驗現象是_________。
(2)B中溶液發生反應的離子方程式是_______________。
(3)步驟③實驗的目的是確認C的黃色溶液中無_____(填化學式)。步驟④能否說明非金屬性:Br>I_______(填“能”或“否”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁是一種活潑的金屬,在高溫下能與Fe2O3反應生成Fe和Al2O3。該反應中___________(填化學式)是還原劑,_____________(填化學式)氧化劑。當2molFe2O3參加反應時,轉移了 ____________ mol電子。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業中很多重要的原料都是來源于石油化工,回答下列問題

(1)C的結構簡式為________。
(2)丙烯酸中含氧官能團的名稱為_____________。
(3)③④反應的反應類型分別為_____________、___________。
(4)寫出下列反應方程式
①反應①的化學方程式____________;
②反應②的化學方程式_________________;
③反應⑤的化學方程式____________。
(5)丙烯酸(CH2 = CH — COOH)可能發生的反應有_______________(填序號)
A 加成反應 B 取代反應 C 加聚反應 D 中和反應 E 氧化反應
(6)丙烯分子中最多有______個原子共面
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,在固定容積的容器中,可逆反應A(g)+3B(g) ![]() 2C(g)達到平衡,此時測得n(A)∶n(B)∶n(C)=2∶2∶1。若保持溫度不變,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向該容器中再充入A、B和C,下列敘述正確的是
2C(g)達到平衡,此時測得n(A)∶n(B)∶n(C)=2∶2∶1。若保持溫度不變,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向該容器中再充入A、B和C,下列敘述正確的是
A. 剛充入時反應速率υ正減少,υ逆增大 B. 平衡不發生移動
C. 平衡向正反應方向移動,A的物質的量濃度減小 D. 物質C的質量分數增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有H2與O2的混合氣體共0.6mol,該混合氣體相對H2的密度為11,則下列說法正確的是( )
A.該混合氣體的平均摩爾質量為11g/mol
B.混合氣體中H2的物質的量為0.3mol
C.混合氣體中O2的質量為12.8g
D.混合氣體中H2和 O2的體積之比為2:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋰海水電池的反應原理為:2Li+2H2O=2LiOH+H2↑,其示意圖如圖所示。有關該電池工作時說法錯誤的是

A.金屬鋰作正極
B.鎳電極上發生還原反應
C.海水作為電解質溶液
D.可將化學能轉化為電能
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com