
| A. | $\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2Og)△H=-267.2 kJ•mol-l | |
| B. | N2H4+O2═N2+2H2O△H=-534.4 kJ•mol-l | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(1)△H=-534.4 kJ•mol-l | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=534.4 kJ•mol-l |
分析 熱化學方程式的書寫:標明物質的聚集狀態;焓變符號中的“+”和“-”代表吸熱和放熱,化學反應的焓變和物質的量相對應,1g火箭燃料肼(N2H4)氣體燃燒生成N2和H2O(g)時,放出16.7kJ的熱量,則32g肼(N2H4)氣體燃燒生成N2和H2O(g)時,放出534.4kJ的熱量,即N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.4kJ/mol,或$\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2Og)△H=-267.2 kJ•mol-l.
解答 解:A、1g火箭燃料肼(N2H4)氣體燃燒生成N2和H2O(g)時,放出16.7kJ的熱量,則32g肼(N2H4)氣體燃燒生成N2和H2O(g)時,放出534.4kJ的熱量,16gN2H4,燃燒放熱267.2 kJ,熱化學方程式為:$\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2Og)△H=-267.2 kJ•mol-l,故A正確;
B、沒注明物質的聚集狀態,故B錯誤;
C、1g火箭燃料肼(N2H4)氣體燃燒生成N2和H2O(g)時,放出16.7kJ的熱量,則32g肼(N2H4)氣體燃燒生成N2和H2O(g)時,放出534.4kJ的熱量,即N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.4kJ/mol,故C錯誤;
D、反應為放熱,焓變為負值,故D錯誤;
故選A.
點評 本題主要考查了熱化學方程式的書寫和注意問題,難度不大,根據課本知識即可完成.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 碳酸鈉粉末滴少量水變成碳酸鈉晶體:Na2CO3+xH2O═Na2CO3•xH2O | |
| B. | 飽和氯水中滴入NaHCO3溶液產生氣泡:HClO+HCO3-═CO2↑+H2O+ClO- | |
| C. | 鈉在空氣中燃燒:4Na+O2═2Na2O | |
| D. | 大理石溶于鹽酸:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
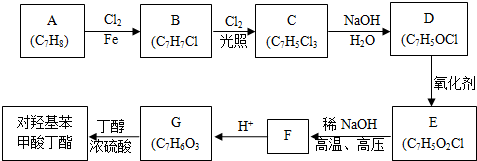 對羥基甲苯甲酸丁酯(俗稱尼泊金丁酯)可用作防腐劑,工業上常用對羥基苯甲酸與丁醇在濃硫酸催化下進行酯化反應而制得.:
對羥基甲苯甲酸丁酯(俗稱尼泊金丁酯)可用作防腐劑,工業上常用對羥基苯甲酸與丁醇在濃硫酸催化下進行酯化反應而制得.: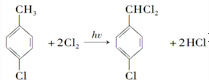 ,
, ;
;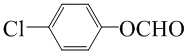 (寫結構簡式).
(寫結構簡式).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4L H2中所含質子數、中子數均為2NA | |
| B. | 46g NO2氣體和46g N2O4氣體的分子數之比為2:1 | |
| C. | 1L 1 mol•L-1的鹽酸中所含粒子總數為2NA | |
| D. | 71g氯氣與足量鐵粉充分反應,轉移的電子數為3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若銅有剩余,則向反應后的溶液中再滴加硫酸,銅也不能溶解 | |
| B. | 若金屬全部溶解,則反應后的溶液中一定含有Cu2+、Fe3+離子 | |
| C. | 若鐵粉全部轉化為Fe2+離子,則b的值為0.8 | |
| D. | 若反應后的溶液中n(Fe3+):n(Fe2+)=3:2,則產生的NO為5152 mL(標準狀況) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、Fe3+、Cl-、ClO- | B. | Na+、K+、Ba2+、HCO3- | ||
| C. | Mg2+、NH4+、SO42-、Cl- | D. | Na+、K+、Cl-、SO42- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com