
晶體硅是一種重要的非金屬材料,制備純硅的主要步驟如下:
①高溫下用碳還原二氧化硅制得粗硅
②粗硅與干燥HCl氣體反應制得SiHCl3:Si+3HCl SiHCl3+H2
SiHCl3+H2
③SiHCl3與過量H2在1 000~1 100 ℃反應制得純硅。
已知SiHCl3能與H2O強烈反應,在空氣中易自燃。
請回答下列問題:
(1)第①步制備粗硅的化學反應方程式為________________________________。
(2)粗硅與HCl反應完全后,經冷凝得到的SiHCl3(沸點-33 ℃)中含有少量SiCl4(沸點57.6 ℃)和HCl(沸點-84.7 ℃),提純SiHCl3采用的方法為________。
(3)用SiHCl3與過量H2反應制備純硅的裝置如下圖(熱源及夾持裝置略去)

①裝置B中的試劑是________。裝置C中的燒瓶需要加熱,其目的是___________________________________________________________。
②反應一段時間后,裝置D中觀察到的現象是________,裝置D不能采用普通玻璃管的原因是__________________________________________________。
裝置D中發生反應的化學方程式為____________________________________。
③為保證制備純硅實驗的成功,操作的關鍵是檢查實驗裝置的氣密性,控制好反應溫度以及________________________________________________。
④為鑒定產品硅中是否含微量鐵單質,將試樣用稀鹽酸溶解,取上層清液后需再加入的試劑是(填寫字母代號)________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
(1)SiO2+2C Si+2CO↑ (2)分餾(或蒸餾)
Si+2CO↑ (2)分餾(或蒸餾)
(3)①濃硫酸 使滴入燒瓶中的SiHCl3汽化 ②有固體生成 在該反應溫度下,普通玻璃管會軟化
SiHCl3+H2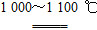 Si+3HCl ③排盡裝置內的空氣 ④bd
Si+3HCl ③排盡裝置內的空氣 ④bd
【解析】 解決分離沸點不同的液體方法就是分餾;根據題干“SiHCl3能與H2O強烈反應,在空氣中自燃”可知道H2的作用之一就是排盡裝置內空氣,防止SiHCl3自燃,而且H2必須是干燥的,可知B的作用就是干燥H2,所以選用濃H2SO4。由于通入D中應是穩定的SiHCl3與過量H2的氣流。所以C裝置要加熱,并且是水浴加熱。由D裝置應加熱到1 000~1 100 ℃,所以必須用石英管。鑒定是否含鐵單質,用稀HCl溶解后生成Fe2+,如果選用NaOH會將生成的Si也溶解,所以考慮轉化為Fe3+后再檢驗,故選b、d。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源:2014學年高一化學人教版必修2 1.1.1元素周期表練習卷(解析版) 題型:選擇題
下列各圖若為元素周期表的一部分(表中數字代表原子序數),其中合理的是
( )。

查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習江蘇專用 高考模擬演練2練習卷(解析版) 題型:選擇題
從海水中提取鎂的工藝流程如圖所示。

下列說法錯誤的是( )。
A.用此法提取鎂的優點之一是原料來源豐富
B.步驟⑦電解MgCl2時陰極產生氯氣
C.步驟⑥可將晶體置于HCl氣氛中脫水
D.上述工藝流程中涉及化合、分解和復分解反應
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習江蘇專用 高考模擬演練1練習卷(解析版) 題型:選擇題
下列有關說法正確的是( )。
A.NH4Cl(s)=NH3(g)+HCl(g)室溫下不能自發進行,說明該反應的ΔH<0
B.鍍鋅鐵制品鍍層破損后,鐵制品比受損前更容易生銹,而鍍錫鐵則相反
C.對于N2(g)+3H2(g) 2NH3(g),當其他條件不變時,壓縮氣體體積使壓強增大,正反應和逆反應速率以及H2的平衡轉化率均增大
2NH3(g),當其他條件不變時,壓縮氣體體積使壓強增大,正反應和逆反應速率以及H2的平衡轉化率均增大
D.100 ℃時水的離子積常數KW為5.5×10-13,說明水的電離是放熱反應
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習江蘇專用 高考模擬演練1練習卷(解析版) 題型:選擇題
下列有關物質的性質或應用的說法正確的是( )。
A.鋁合金是一種混合物,它比純鋁的熔點高
B.水晶項鏈和餐桌上的瓷盤都是硅酸鹽制品
C.一定條件下,秸稈可以制得葡萄糖和酒精
D.從海水中得到氯化鎂,電解氯化鎂溶液可獲得Mg
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習江蘇專用 第9講非金屬元素及其化合物練習卷(解析版) 題型:選擇題
已知X為一種常見酸的濃溶液,能使蔗糖變黑。A與X反應的轉化關系如圖所示,其中反應條件及部分產物均已略去,則下列有關說法正確的是( )。

A.X使蔗糖變黑的現象主要體現了X的脫水性
B.若A為鐵,則足量A與X在室溫下即可完全反應
C.若A為碳單質,則將C通入少量的澄清石灰水中,一定可以觀察到白色沉淀產生
D.工業上,B轉化為D的反應條件為高溫、常壓、使用催化劑
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習江蘇專用 第8講電化學練習卷(解析版) 題型:填空題
太陽能電池可用做電解的電源(如圖)。
(1)若c、d均為惰性電極,電解質溶液為硫酸銅溶液,電解過程中,c極先無氣體產生,后又生成氣體,則c極為________極,在電解過程中,溶液的pH________(填“增大”、“減小”或“不變”),停止電解后,為使溶液恢復至原溶液應加入適量的________。

(2)若c、d均為銅電極,電解質溶液為氯化鈉溶液,則電解時,溶液中氯離子的物質的量將________(填“增大”、“減小”或“不變”)。
(3)若用石墨、鐵作電極材料,可組裝成一個簡易污水處理裝置。其原理是:加入試劑調節污水的pH在5.0~6.0之間。接通電源后,陰極產生的氣體將污物帶到水面形成浮渣而刮去,起到浮選凈化作用;陽極產生的有色沉淀具有吸附性,吸附污物而沉積,起到凝聚凈化作用。該裝置中,陰極的電極反應式為_______________________________________;
陽極區生成的有色沉淀是________。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習江蘇專用 第7講水溶液中的離子平衡練習卷(解析版) 題型:選擇題
50 ℃時,下列各溶液中,離子的物質的量濃度關系正確的是( )。
A.pH=4的醋酸中:c(H+)=4.0 mol·L-1
B.飽和小蘇打溶液中:c(Na+)=c(HCO3—)
C.飽和食鹽水中:c(Na+)+c(H+)=c(Cl-)+c(OH-)
D.pH=12的純堿溶液中:c(OH-)=1.0×10-2 mol·L-1
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習江蘇專用 第4講物質結構元素周期律練習卷(解析版) 題型:選擇題
不具有放射性的同位素稱為穩定同位素,穩定同位素分析法近20年來在植物生理學、生態學和環境科學研究中獲得廣泛應用。如在陸地生態系統研究中,2H、13C、15N、18O、34S等常用作環境分析指示物。下列有關說法正確的是 ( )。
A.34S原子核內中子數為16
B.1H216O和1H218O的相對分子質量不同
C.13C和15N原子核內的質子數相差2
D.2H+結合OH-的能力比1H+的更強
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com