
| 投料比[n(NO2)/n(CH4)] | 400K | 500K | 600K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
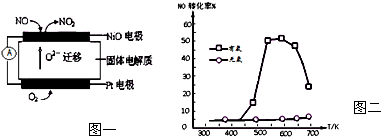
分析 (1)根據圖片知,鉑電極上氧氣得電子作正極,NiO電極上NO失電子發生氧化反應生成NO2;
(2)根據方程式①②的加減得出化學方程式③,焓變相應的加減,從而計算出△H3;
(3)①A.催化劑對轉化率無影響;
B.催化劑對轉化率無影響;
C.該反應為放熱反應,降低溫度,平衡正移;
D.增大壓強,平衡向氣體體積減小的方向移動;
E.減少生成物的濃度,平衡正移;
F.由表中數據可知,[n(NO2)/n(CH4)]越大,NO2轉化率越小;
②400K時,將投料比為1的NO2和CH4的混合氣體共0.40mol,則NO2和CH4各為0.2mol,NO2的平衡轉化率為60%,利用三段式求出平衡濃度,再求平衡常數K;
③從0~5min,CO2的濃度從0逐漸增大到0.03mol/L,5min~10min,CO2的濃度保持不變,在10min時將容器的容積快速壓縮為1L,CO2的濃度瞬間變為0.06mol/L,然后逐漸減小,達到平衡時,CO2平衡濃度大于0.03 mol/L;
(4)反應4NO(g)+4NH3(g)+O2(g)?4N2(g)+6H2O(g)△H=-1627.2kJ•mol-1是放熱反應,升溫平衡逆向移動,溫度升高時還會發生氨氣的催化氧化.
解答 解:(1)負極NiO上一氧化氮失電子和氧離子反應生成二氧化氮,電極反應式為NO-2e-+O2-═NO2,
故答案為:NO+O2--2e-=NO2;
(2)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2<0
③CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H3
由蓋斯定律可知,方程式③=$\frac{1}{2}$(②+①)則△H3=$\frac{△{H}_{1}+△{H}_{2}}{2}$;
故答案為:$\frac{△{H}_{1}+△{H}_{2}}{2}$;
(3)①A.催化劑對轉化率無影響,則增加催化劑的表面積,NO2轉化率不變,故A錯誤;
B.催化劑對轉化率無影響,改用高效催化劑,NO2轉化率不變,故B錯誤;
C.該反應為放熱反應,降低溫度,平衡正移,則NO2轉化率增大,故C正確;
D.增大壓強,平衡向氣體體積減小的方向移動,則平衡向逆方向移動,所以NO2轉化率減小,故D錯誤;
E.減少生成物的濃度,平衡正移,所以分離出H2O(g),平衡正移,則NO2轉化率增大,故E正確;
F.由表中數據可知,[n(NO2)/n(CH4)]越大,NO2轉化率越小,減小[n(NO2)/n(CH4)],NO2轉化率增大,故F正確;
故答案為:CEF;
②400K時,將投料比為1的NO2和CH4的混合氣體共0.40mol,則NO2和CH4各為0.2mol,NO2的平衡轉化率為60%,
依題意得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)
c(始) mol/L:0.10 0.10 0 0 0
c(變) mol/L:0.03 0.06 0.03 0.03 0.06
c(平 )mol/L:0.07 0.04 0.03 0.03 0.06
K=$\frac{c({N}_{2})•{c}^{2}({H}_{2}O)•c(C{O}_{2})}{c(C{H}_{4})•{c}^{2}(N{O}_{2})}$=$\frac{0.03×0.0{6}^{2}×0.03}{0.07×0.0{4}^{2}}$=2.89×10-2,
答:該溫度時的平衡常數2.89×10-2;
③從0~5min,CO2的濃度從0逐漸增大到0.03mol/L,5min~10min,CO2的濃度保持不變,在10min時將容器的容積快速壓縮為1L,CO2的濃度瞬間變為0.06mol/L,然后逐漸減小,達到平衡時,CO2平衡濃度大于0.03 mol/L,則作圖為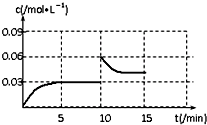 ;
;
故答案為: ;
;
(4)反應4NO(g)+4NH3(g)+O2(g)?4N2(g)+6H2O(g)△H=-1627.2kJ•mol-1是放熱反應,升溫平衡逆向移動,溫度升高時還會發生氨氣的催化氧化,
故答案為:脫氮反應是放熱反應,達到平衡后升高溫度,平衡逆向移動;溫度升高發生了副反應:4NH3+5O2═4NO+6H2O.
點評 本題考查了蓋斯定律的應用、原電池原理及電極反應書寫、化學反應速率和化學平衡的影響因素、K的計算等知識,題目難度較大,試題涉及的題量較大,知識點較多、綜合性強,熟練掌握知識的遷移和應用是解答本題的關鍵,試題培養了學生的分析、理解能力及靈活應用所學知識的能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯酸鉀和二氧化錳的混合物制取氧氣 | |
| B. | 石灰石和鹽酸制取二氧化碳 | |
| C. | 濃鹽酸和二氧化錳制取氯氣 | |
| D. | 銅與稀硝酸反應制取一氧化氮 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在硫酸銅溶液中加入過量氫氧化鋇溶液 Ba2++SO42-=BaSO4↓ | |
| B. | 鈉與水的反應Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氯氣通入氫氧化鈉溶液中 2Cl2+2OH-=3Cl-+ClO-+H2O | |
| D. | 大理石溶于醋酸的反應CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 研究金屬鐵及其化合物的性質有重要意義.
研究金屬鐵及其化合物的性質有重要意義.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 用途 | 解釋 |
| A | 硅膠可作袋裝食品的干燥劑 | 硅膠多孔,吸收空氣中氧氣的能力強 |
| B | CuSO4可作游泳池的消毒劑 | 銅鹽能使構成病毒的蛋白質變性 |
| C | 浸有高錳酸鉀溶液的硅藻土可作某些水果的保鮮劑 | 高錳酸鉀溶液能氧化水果釋放的催熟劑乙烯 |
| D | Na2O2可作呼吸面具中的供氧劑 | Na2O2能吸收CO2同時放出O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{y-2x}{a}$ mol/L | B. | $\frac{y-x}{a}$ mol/L | C. | $\frac{2y-2x}{a}$ mol/L | D. | $\frac{2y-4x}{a}$mol/L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com