
甲醇是一種可再生能源,具有廣泛的開發和應用前景。
(1)工業上一般采用下列兩種反應合成甲醇:
反應Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反應Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反應符合“原子經濟”原則的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列數據是反應Ⅰ在不同溫度下的化學平衡常數(K)。
溫度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.041 | 0.270 | 0.012 |
由表中數據判斷,ΔH1______0(填“>”、“=”或“<”)。
③某溫度下,將2 mol CO和6 mol H2充入2 L的密閉容器中,充分反應,達到平衡后,測得c(CO)=0.2 mol·L-1,則CO的轉化率為________,此時的溫度為________(從上表中選擇)。
(2)已知在常溫常壓下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
寫出甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式:__________。
(1)①Ⅰ ②< ③80% 250 ℃
(2)CH3OH(l)+O2(g)===CO(g)+2H2O(l)
ΔH=-442.8 kJ·mol-1
【解析】 (1)①反應Ⅰ的產物只有甲醇,而反應Ⅱ的產物有兩種,故反應Ⅰ符合“原子經濟”原則;②觀察圖表數據可得,升溫時,K值變小,說明該反應的正反應為放熱反應,即ΔH1<0;③CO的轉化率為(2 mol-0.2 mol·L-1×2 L)/2 mol×100%=80%;此時的化學平衡常數為K=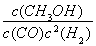 =
=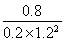 ≈2.041,故此時的溫度為250 ℃。(2)將三個熱化學方程式進行變形:[①+(-②)+4×③]×
≈2.041,故此時的溫度為250 ℃。(2)將三個熱化學方程式進行變形:[①+(-②)+4×③]×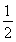 ,可得甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式,即CH3OH(l)+O2(g)===CO(g)+2H2O(l) ΔH=[ΔH1+(-ΔH2)+4ΔH3]×
,可得甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式,即CH3OH(l)+O2(g)===CO(g)+2H2O(l) ΔH=[ΔH1+(-ΔH2)+4ΔH3]×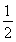 =-442.8 kJ·mol-1。
=-442.8 kJ·mol-1。


科目:高中化學 來源:2013-2014學年高考化學二輪復習 專題8電化學原理練習卷(解析版) 題型:選擇題
將KCl和CuSO4兩種溶液等體積混合后,用石墨電極進行電解,電解過程中,溶液pH隨時間t變化的曲線如圖所示,則下列說法正確的是 ( )。

A.整個過程中兩電極反應2Cl--2e-===Cl2↑、2H++2e-===H2↑不可能同時發生
B.電解至c點時,往電解液中加入適量CuCl2固體,即可使電解液恢復至原來的濃度
C.ab段表示電解過程中H+被還原,pH上升
D.原混合溶液中KCl和CuSO4的濃度之比恰好為2∶1
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習 專題6化學反應速率和化學平衡練習卷(解析版) 題型:填空題
25 ℃時,在體積為2 L的密閉容器中,氣態A、B、C的物質的量n隨時間t的變化如圖1所示,已知達到平衡后,降低溫度,A的轉化率將增大。

t2~t3 | t4~t5 | t5~t6 | t7~t8 |
K1 | K2 | K3 | K4 |
(1)根據圖1數據,寫出該反應的化學方程式:__________________。此反應的平衡常數表達式K=___,從反應開始到第一次平衡時的平均速率v(A)為___。
(2)在5~7 min內,若K值不變,則此處曲線變化的原因是__________。
(3)如圖2表示此反應的反應速率v和時間t的關系圖,各階段的平衡常數如表所示。K1、K2、K3、K4之間的關系為________(用“>”、“<”或“=”連接)。A的轉化率最大的一段時間是________。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習 專題6化學反應速率和化學平衡練習卷(解析版) 題型:選擇題
在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3— (aq)。測得不同溫度下該反應的平衡常數K如表所示:
I3— (aq)。測得不同溫度下該反應的平衡常數K如表所示:
t/℃ | 5 | 15 | 25 | 35 | 50 |
K | 1 100 | 841 | 689 | 533 | 409 |
下列說法正確的是 ( )。
A.反應I2(aq)+I-(aq) I3— (aq)的ΔH>0
I3— (aq)的ΔH>0
B.其他條件不變,升高溫度,溶液中c(I3—)減小
C.該反應的平衡常數表達式為K=
D.25 ℃時,向溶液中加入少量KI固體,平衡常數K小于689
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習 專題5化學反應與能量變化練習卷(解析版) 題型:選擇題
(2013·廣東中山一模,11)下列依據熱化學方程式得出的結論正確的是(雙選)( )。
A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,則氫氣的燃燒熱為241.8 kJ·mol-1
B.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,則含40.0 g NaOH的稀溶液與稀醋酸完全中和,放出小于57.3 kJ的熱量
C.已知2C(s)+2O2(g)===2CO2(g) ΔH=a;2C(s)+O2(g)===2CO(g) ΔH=b,則a>b
D.已知C(石墨,s)===C(金剛石,s) ΔH>0,則石墨比金剛石穩定
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習 專題4物質結構與元素周期律練習卷(解析版) 題型:填空題
X、Y、Z、L、M五種元素的原子序數依次增大。X、Y、Z、L是組成蛋白質的基礎元素,M是地殼中含量最高的金屬元素。
回答下列問題:
(1)L的元素符號為________;M在元素周期表中的位置為________;五種元素的原子半徑從大到小的順序是________(用元素符號表示)。
(2)Z、X兩元素按原子數目比1∶3和2∶4構成分子A和B,A的電子式為________,B的結構式為________。
(3)硒(Se)是人體必需的微量元素,與L同一主族,Se原子比L原子多兩個電子層,則Se的原子序數為________,其最高價氧化物對應的水化物化學式為________,該族二~五周期元素單質分別與H2反應生成1 mol氣態氫化物的反應熱如下,表示生成1 mol硒化氫反應熱的是________(填字母代號)。
a.+99.7 kJ·mol-1 b.+29.7 kJ·mol-1c.-20.6 kJ·mol-1 d.-241.8 kJ·mol-1
(4)用M單質作陽極,石墨作陰極,NaHCO3溶液作電解液進行電解,生成難溶物R,R受熱分解生成化合物Q。寫出陽極生成R的電極反應式:____________________________________;由R生成Q的化學方程式為________________________________________________________。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習 專題3中學化學常見的兩種重要反應類型練習卷(解析版) 題型:選擇題
下列離子方程式正確的是(雙選)( )。
A.氯化鐵溶液中加入銅粉:2Fe3++Cu===2Fe2++Cu2+
B.向氫氧化亞鐵中加入足量稀硝酸:Fe(OH)2+2H+===Fe2++2H2O
C.硫酸銅溶液與足量氫氧化鋇溶液混合:Ba2++SO42—===BaSO4↓
D.向硫酸氫鈉溶液中滴加Ba(OH)2溶液至中性:2H++SO42—+Ba2++2OH-===BaSO4↓+2H2O
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習 專題1物質的組成分類性質及化學用語練習卷(解析版) 題型:選擇題
下列敘述正確的是( )。
A.鹽酸和食醋既是化合物又是酸
B.純堿、CuSO4·5H2O和生石灰分別屬于鹽、混合物和氧化物
C.膠體處于介穩定狀態,所以放置一會便會有沉淀生成
D.膠體區別于其他分散系的本質特征是分散質粒子直徑的大小
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com