
 尿素(H2NCONH2)是一種農業生產中常用的氮肥.在工業上,尿素還用于制造有機鐵肥,回答下列問題:
尿素(H2NCONH2)是一種農業生產中常用的氮肥.在工業上,尿素還用于制造有機鐵肥,回答下列問題:分析 (1)Fe原子核外電子數為26,核外電子排布為1s22s22p63s23p63d64s2;
(2)同一周期元素的第一電離能隨著原子序數的增大而呈增大的趨勢,但第IIA族和第VA族元素的第一電離能大于相鄰元素;
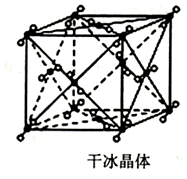
(3)利用均攤法計算CO2分子數;
(4)計算雜化類型時根據電子對數來判斷,中心原子的價電子數與配體電子數的和除以2就得到電子對數,根據電子對數,可以確定雜化類型
(5)原子個數相等價電子數相等的微粒是等電子體.
解答 解:(1)Fe原子核外有26個電子,核外電子排布為1s22s22p63s23p63d64s2,Fe原子失去4s能級2個電子形成Fe2+,Fe2+電子排布式為1s22s22p63s23p63d5,故答案為:1s22s22p63s23p63d6;
(2)同一周期元素的第一電離能隨著原子序數的增大而呈增大的趨勢,但第IIA族和第VA族元素的第一電離能大于相鄰元素,所以C、N、O三種元素的第一電離能由小到大的順序為:C<O<N;故答案為:C<O<N;
(3)C02分子晶體的晶胞中CO2分子位于立方體的頂點和面心上,則每個C02分子晶體晶胞占有CO2分子為8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故答案為:4;
(4)中心原子為碳,價電子數為4,氧不為中心原子,不提供電子,每個亞氨基提供一個電子,電子對數為(4+1×2)÷2=3,故雜化軌道為sp2,σ鍵的數目為3,每個亞氨基中σ鍵的數目2,一分子尿素中含σ鍵的數目為3+2×2=7,故每摩爾尿素中含有σ鍵的數目為7NA,
故答案為:sp2;7;
(5)原子個數相等價電子數相等的微粒是等電子體,NO3-原子數為4,價電子數為24,則其等電子體為:SO3或者BF3,故答案為:SO3或者BF3.
點評 本題考查了原子的雜化方式、核外電子排布式的書寫、晶胞計算等知識點,其中電子排布式、原子的雜化方式是高考的熱點,是學習的重點.


科目:高中化學 來源: 題型:選擇題
| A. | 苯萃取碘水中的I2,分出水層的操作為從上口倒出 | |
| B. | 在未知溶液中滴加BaCl2溶液出現白色沉淀,加稀硝酸,沉淀不溶解,說明該未知溶液中存在SO42-或SO32- | |
| C. | 做蒸餾實驗時,在蒸餾燒瓶中應加入沸石,以防暴沸.如果在沸騰前發現忘記加沸石,應立即停止加熱,冷卻后補加 | |
| D. | 配制245mL0.1 mol•L-1的NaOH溶液,需要245mL容量瓶 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯氣和水 | B. | 氯化氫和水 | ||
| C. | 二氧化碳和燒堿溶液 | D. | 氯氣和燒堿溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
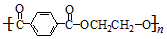 )簡稱PET,俗稱“的確良”,是一種性能良好的樹脂材料,常用于合成化學纖維.下列有關說法正確的是( )
)簡稱PET,俗稱“的確良”,是一種性能良好的樹脂材料,常用于合成化學纖維.下列有關說法正確的是( )| A. | 合成PET的單體為對苯二甲酸和乙醇 | |
| B. | PET可通過縮聚反應獲得 | |
| C. | 1mol對苯二甲酸最多可以與5mol氫氣發生加成反應 | |
| D. | PET與 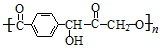 互為同分異構體 互為同分異構體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水的摩爾質量是18 g•mol-1 | B. | 硫離子的結構示意圖: | ||
| C. | 8個質子、10個中子的原子:${\;}_{8}^{18}$O | D. | 四氯化硅中Si的化合價為-4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 聚四氟乙烯的單體是不飽和烴 | |
| B. | 聚四氟乙烯中含有碳碳雙鍵 | |
| C. | 聚四氟乙烯有固定熔點 | |
| D. | 四氟乙烯中既含有極性鍵又含有非極性鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 甲醇(CH3OH)燃料電池(DNFC)被認為是21世紀電動汽車最佳候選動力源.
甲醇(CH3OH)燃料電池(DNFC)被認為是21世紀電動汽車最佳候選動力源.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
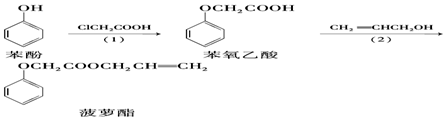
| A. | 步驟(1)產物中殘留的苯酚可用FeCl3溶液檢驗 | |
| B. | 苯酚和菠蘿酯均可與酸性KMnO4溶液發生反應 | |
| C. | 苯氧乙酸分子中含有醚鍵、羧基兩種官能團 | |
| D. | 步驟(2)產物中殘留的烯丙醇可用溴水檢驗 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com