

分析 Al(OH)3、H2SO4發生反應為2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O;
工業(NH4)2SO4(含FeSO4)溶于水,然后向溶液中加入雙氧水,雙氧水具有氧化性、硫酸亞鐵具有還原性,二者發生氧化還原反應生成鐵離子和水,離子方程式為2Fe2++H2O2+2H+═2Fe3++2H2O,將得到的溶液中加入氨水,調節溶液的pH,使鐵離子轉化為Fe(OH)3沉淀,然后過濾得到濾渣;將濾液加入硫酸鋁溶液中,通過分離得到固體NH4Al(SO4)2•12H2O,加熱固體NH4Al(SO4)2•12H2O,該物質分解生成M和含鋁物質,
(1)雙氧水和亞鐵離子發生氧化還原反應生成鐵離子和水;
(2)中和液中的雜質離子是鐵離子,鐵離子用KSCN溶液檢驗;
(3)633℃時剩余固體質量分數是反應前的37.75%,根據硫酸鋁銨晶體分解情況分析,得出化學式;
(4)M的主要成分的化學式是NH3、H2O、SO3 ;可以用水或者濃硫酸吸收生成硫酸銨,以便重復利用.
解答 解:Al(OH)3、H2SO4發生反應為2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O;
工業(NH4)2SO4(含FeSO4)溶于水,然后向溶液中加入雙氧水,雙氧水具有氧化性、硫酸亞鐵具有還原性,二者發生氧化還原反應生成鐵離子和水,離子方程式為2Fe2++H2O2+2H+═2Fe3++2H2O,將得到的溶液中加入氨水,調節溶液的pH,使鐵離子轉化為Fe(OH)3沉淀,然后過濾得到濾渣;將濾液加入硫酸鋁溶液中,通過分離得到固體NH4Al(SO4)2•12H2O,加熱固體NH4Al(SO4)2•12H2O,該物質分解生成M和含鋁物質,
(1)雙氧水和亞鐵離子發生氧化還原反應生成鐵離子和水,離子反應方程式為2Fe2++H2O2+2H+═2Fe3++2H2O,故答案為:2Fe2++H2O2+2H+═2Fe3++2H2O;
(2)中和液中的雜質離子是鐵離子,鐵離子用KSCN溶液檢驗,其檢驗方法為取少量中和后的溶液,滴加KSCN溶液,若溶液不變紅,則已完全除去;若溶液變紅,則未除盡,
故答案為:取少量中和后的溶液,滴加KSCN溶液,若溶液不變紅,則已完全除去;若溶液變紅,則未除盡;
(3)假設有1mol硫酸鋁銨晶體,摩爾質量是453g/mol,質量是453g,最后得到的是氧化鋁,硫酸鋁銨晶體加熱過程中會分解,分別生成了水、氨氣、三氧化硫;
當結晶水完全失去時,剩余固體與原始固體的質量百分比是:$\frac{18×12}{453}$×100%≈52.32%,大于這個值,說明結晶水沒有完全失去;
當溫度繼續升高,硫酸鋁銨中的硫酸銨開始分解生成氨氣和三氧化硫,硫酸銨完全分解時,剩余物為硫酸鋁,剩余固體與原始固體的質量百分比是:$\frac{171}{453}$×100%≈37.75%;當比值大于37.75%時,硫酸銨沒有完全分解,當等于這個比值,說明硫酸銨恰好分解完全,小于這個比值,硫酸鋁開始分解;故B點剩余固體是硫酸鋁;
故答案是:Al2(SO4)3;
(4)根據(3)知,流程圖中M的主要成分的化學式為NH3、H2O、SO3 ;可以用水或者濃硫酸吸收生成硫酸銨重復使用;
故答案是:NH3、H2O、SO3;濃硫酸或水.
點評 本題考查物質制備實驗方案評價,為高頻考點,側重考查學生分析、推斷、計算能力,明確流程圖中發生的反應及基本操作是解本題關鍵,難點是(3)題有關計算,題目難度中等.


 名校名卷單元同步訓練測試題系列答案
名校名卷單元同步訓練測試題系列答案科目:高中化學 來源: 題型:選擇題
| A. | A與B兩種氣體的相對分子質量之比為a:b | |
| B. | 同質量的A、B兩種氣體分子數之比為b:a | |
| C. | 同溫同壓時,兩種氣體A與B的密度之比為a:b | |
| D. | 同溫同體積時,同質量的A、B兩種氣體的壓強之比為a:b |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向CuSO4溶液中加入NaOH溶液得到的分散系 | |
| B. | 向水中加入食鹽得到的分散系 | |
| C. | 向沸水中滴入飽和FeCl3溶液得到的紅褐色液體 | |
| D. | 向NaOH溶液中通入CO2得到的無色溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
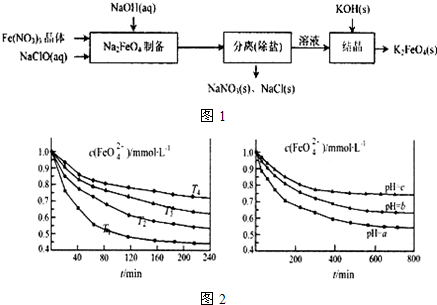
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
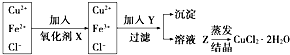 工業上制取純凈的CuCl2•2H2O的主要過程是:
工業上制取純凈的CuCl2•2H2O的主要過程是:查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 )甲酯并計算其產率.實驗步驟如下:
)甲酯并計算其產率.實驗步驟如下: 水形成的共沸物,其沸點為85℃;該實驗中加入甲苯,易將水蒸出),再小心地加入5mL濃硫酸,搖動混勻后加入1~2粒沸石,組裝好實驗裝置,在85~95℃下恒溫加熱反應1.5小時:
水形成的共沸物,其沸點為85℃;該實驗中加入甲苯,易將水蒸出),再小心地加入5mL濃硫酸,搖動混勻后加入1~2粒沸石,組裝好實驗裝置,在85~95℃下恒溫加熱反應1.5小時:| 名稱 | 分子量 | 顏色狀態 | 相對密度 | 熔點(℃) | 沸點(℃) |
| 水楊酸甲酯 | 152 | 無色液體 | 1.18 | -8.6 | 224 |
| 水楊酸 | 138 | 白色晶體 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 無色液體 | 0.792 | -97 | 64.7 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
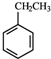 (g)+CO2(g)?
(g)+CO2(g)?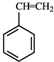 (g)+CO(g)+H2O(g)△H=-166KJ/mol
(g)+CO(g)+H2O(g)△H=-166KJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol/L的醋酸溶液中c(H+)=0.1mol/L | |
| B. | 0.1mol/L 的NaClO溶液中pH>7 | |
| C. | 任何一個化學變化都伴隨著能量的變化 | |
| D. | 新制的氯水中存在著三種分子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com