
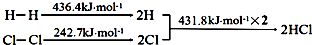
| A. | H-H鍵比Cl-Cl鍵穩定 | |
| B. | △H=-184.5 kJ•mol-1 | |
| C. | 正反應活化能比逆反應活化能高 | |
| D. | 在相同條件下,1mol H2(g)和1mol Cl2(g)分別在點燃和光照條件下反應生成2mol HCl(g),重新恢復到原來的狀態時△H相同 |
分析 A.鍵能越大,化學鍵越穩定;
B.△H=反應物鍵能總和-生成物鍵能總和;
C.H2(g)+Cl2(g)═2HCl(g)△H<0,說明正反應活化能比逆反應活化能低;
D.反應熱與反應的條件無關.
解答 解:A.因為H2的鍵能大于Cl2的鍵能,所以H-H鍵比Cl-Cl鍵穩定,故A正確;
B.△H=(436.4 kJ•mol-1+242.7 kJ•mol-1)-(431.8 kJ•mol-1)×2=-184.5 kJ•mol-1,故B正確;
C.H2(g)+Cl2(g)═2HCl(g)△H<0,說明正反應活化能比逆反應活化能低,故C錯誤;
D.△H與起點和終點有關,與反應的條件無關,故D正確;
故選C.
點評 本題考查了反應熱的計算,難度不大,△H=反應物鍵能總和-生成物鍵能總和是計算反應熱的常用公式.


科目:高中化學 來源: 題型:選擇題
| A. | 中子數為18的氯原子:${\;}_{17}^{35}Cl$ | B. | 二氧化碳分子的比例模型: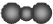 | ||
| C. | HClO的電子式: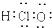 | D. | 甲烷分子的球棍模型: |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Li能在空氣中燃燒 | B. | Li2O只有共價鍵 | ||
| C. | Li2CO3能溶于水 | D. | LiOH受熱不分解 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
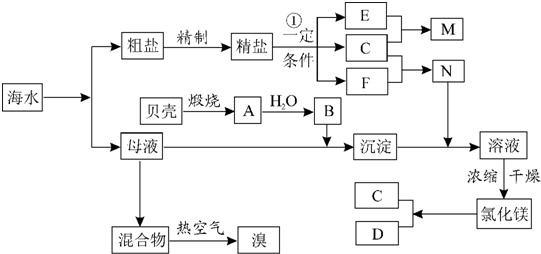
 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 同時減少 | B. | 同時增大 | C. | v(正)增大,v(逆)減少 | D. | v(正)減少,v(逆)增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 10℃20mL 3 mol•L-1的NaHCO3溶液 | B. | 20℃30mL 2 mol•L-1的NaHCO3溶液 | ||
| C. | 20℃10mL 4 mol•L-1的NaHCO3溶液 | D. | 10℃10mL 2 mol•L-1的NaHCO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在現實生活中,電化學腐蝕要比化學腐蝕嚴重的多,危害更大 | |
| B. | 用活性炭為糖漿脫色和用臭氧漂白紙漿,原理不同 | |
| C. | 鋼鐵制品和銅制品既能發生吸氧腐蝕又能發生析氫腐蝕 | |
| D. | 在銅的精煉裝置中,通常用粗銅作作陽極,精銅作陰極 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 單質的沸點:Y<X | B. | 簡單離子半徑:Y<Z | ||
| C. | 鹽M的水溶液顯酸性 | D. | 最高化合價:X>Y>Z |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 無色氣體的質量為0.2g | |
| B. | 原混合物中鐵的質量分數無法計算 | |
| C. | 實驗中消耗的H2SO4物質的量為0.1mol | |
| D. | 溶液中金屬離子物質的量為0.02mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com