
【題目】下列圖示與對應的敘述相符的是( )
A. 圖甲表示可逆反應A(g)+2B(g)2C(g),速率隨外界條件的改變曲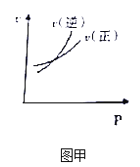
B. 圖乙表示CH3COOH溶液中通入NH3至過量的過程中溶液導電性的變化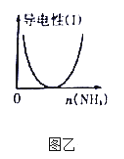
C. 圖丙表示用0.1mol/L NaOH溶液滴定20.00mL 0.1mol/LCH3COOH溶液得到的滴定曲線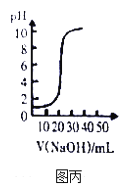
D. 圖丁表示等量NO2在容積相同的恒容密閉容器中,不同溫度下分別發生反應:2NO2(g)N2O4(g)相同時間后測得NO2含量的曲線,則該反應的△H<0 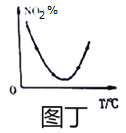
【答案】D
【解析】
A、正反應方向速率等于逆反應方向速率說明反應達到平衡,交點右側考查影響化學平衡移動的因素,該反應是體積減小的反應,增大壓強,平衡向正反應方向移動,即v正>v逆,與圖甲不符合,故A錯誤;
B、CH3COOH是弱電解質,CH3COOH與NH3反應生成CH3COONH4,CH3COONH4為強電解質,向CH3COOH溶液中通入NH3,導電能力增強,與圖乙不符,故B錯誤;
C、醋酸是弱酸,常溫下,0.1mol·L-1的醋酸的pH>1,與圖丙不符,故C錯誤;
D、NO2%最低時,說明反應達到平衡,最低點的右側,升高溫度,NO2%增大,平衡逆向進行,說明該反應的正向為放熱反應,即△H<0,故D正確;
答案選D。


科目:高中化學 來源: 題型:
【題目】經研究發現白蟻信息素有:![]() (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯),![]() (3,7-二甲基-1-辛烯),家蠶的性信息素為:CH3(CH2)8CH==CH—CH==CH(CH2)8CH3。下列說法不正確的是
(3,7-二甲基-1-辛烯),家蠶的性信息素為:CH3(CH2)8CH==CH—CH==CH(CH2)8CH3。下列說法不正確的是
A.2,4-二甲基1庚烯的分子式為C9H18
B.2,4-二甲基-1-庚烯與3,7-二甲基-1-辛烯互為同系物
C.以上三種信息素均能使溴的四氯化碳溶液褪色
D.1 mol家蠶的性信息素與1 mol Br2加成,產物只有一種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H2S在金屬離子的鑒定分析、煤化工等領域都有重要應用。請回答:
Ⅰ.工業上一種制備H2S的方法是在催化劑、高溫條件下,用天然氣與SO2反應,同時生成兩種能參與大氣循環的氧化物。
(1)該反應的化學方程式為_____________。
Ⅱ.H2S可用于檢測和沉淀金屬陽離子。
(2)H2S的第一步電離方程式為________。
(3)已知:25 ℃時,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。該溫度下,向濃度均為0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,當Sn2+開始沉淀時,溶液中c(Cd2+)=________(溶液體積變化忽略不計)。
Ⅲ.H2S是煤化工原料氣脫硫過程的重要中間體。反應原理為
ⅰ.COS(g)+H2(g) ![]() H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
(4)已知:斷裂1 mol分子中的化學鍵所需吸收的能量如表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/(kJ·mol-1) | 1 319 | 442 | x | 678 | 930 | 1 606 |
表中x=________。
(5)向10 L容積不變的密閉容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),進行上述兩個反應。其他條件不變時,體系內CO的平衡體積分數與溫度(T)的關系如圖所示。
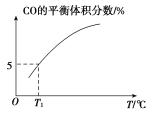
①隨著溫度升高,CO的平衡體積分數_____(填“增大”或“減小”)。原因為_______
②T1℃時,測得平衡時體系中COS的物質的量為0.80 mol。則該溫度下,COS的平衡轉化率為_____;反應ⅰ的平衡常數為_____(保留兩位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用化學反應原理研究氮的氧化物和硫的氧化物有著重要的意義。
(1)已知:2SO2(g)+ O2(g)![]() 2SO3(g) △H1
2SO3(g) △H1
2NO(g)+ O2(g)![]() 2NO2 (g) △H2
2NO2 (g) △H2
NO2 (g) + SO2(g)![]() SO3(g) + NO(g) △H3
SO3(g) + NO(g) △H3
則△H3 =__________(用△H1、△H2表示),如果上述三個反應方程式的平衡常數分別為K1、 K2、K3,則K3 =__________(用K1、K2表示)。
(2)如圖所示,A 是恒容的密閉容器,B 是一個體積可變的充氣氣囊。保持恒溫,關閉K2,分別將2mol NO 和1 mol O2通過K1、K3分別充入A、B 中,發生的反應為2NO(g)+ O2(g)![]() 2NO2 (g) [不考慮2NO2 (g)
2NO2 (g) [不考慮2NO2 (g)![]() N2 O4 (g) ],起始時A、B 的體積相同均為a L。
N2 O4 (g) ],起始時A、B 的體積相同均為a L。
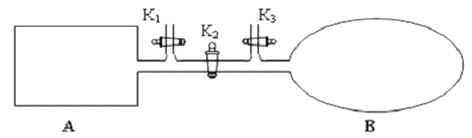
①下列說法和示意圖正確,且既能說明A 容器中反應達到平衡狀態,又能說明B 容器中反應達到平衡狀態的是_________。
a. A、B 容器中氣體的顏色均不再發生變化
b. A、B 容器中NO 和O2物質的量濃度比均為2:1

② T℃時,A 容器中反應達到平衡時的平衡常數Kp = 8×10﹣2 (kPa)﹣1。若A 容器中反應達到平衡時p(NO2) = 200kPa,則平衡時NO的轉化率為_____________。(Kp 是用平衡分壓代替平衡濃度計算所得平衡常數,分壓=總壓×物質的量分數)
(3)將0.2 mol SO2和0.15 mol O2通入2L 的密閉容器中,測得SO2的物質的量隨時間變化如 圖實線 所示。
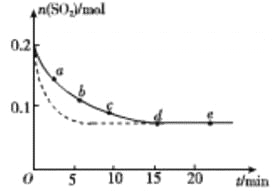
編號 | a | b | c | d | e |
n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
t/min | 2 | 5 | 8 | 15 | 22 |
①ab 段平均反應速率____________(填“大于”“小于”或“等于”)bc 段平均反應速率:de 段平均反應速率為_________________。
②僅改變某一個實驗條件,測得SO2的物質的量隨時間變化如圖中虛線所示,則改變的條件是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】沼氣是一種能源,它的主要成分是CH4。0.5molCH4完全燃燒生成CO2氣體和液體H2O時,放出445kJ熱量,則下列熱化學方程式中正確的是( )
A.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=+890kJ·mol-1
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ·mol-1
D.![]() CH4(g)+O2(g)=
CH4(g)+O2(g)= ![]() CO2(g)+H2O(l) △H=-890kJ·mol-1
CO2(g)+H2O(l) △H=-890kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于鋁熱反應的現象有如下描述:反應放出大量的熱,并發出耀眼的光芒;紙漏斗的下部被燒穿,有熔融物落入沙中。已知![]() 、
、![]() 、
、![]() 、
、![]() 的熔點、沸點如表所示:
的熔點、沸點如表所示:
物質 |
|
|
|
|
熔點/℃ | 660 | 1565 | 2054 | 1535 |
沸點/℃ | 2467 | 3414 | 2980 | 2750 |
(1)某同學推測,鋁熱反應所得到的熔融物是鐵鋁合金,因為該反應放熱能使鐵熔化,而鋁的熔點比鐵的低,此時液態的鐵和鋁形成鐵鋁合金。你認為他的解釋是否合理?________(填“合理”或“不合理”)。
(2)設計一個簡單的實驗,證明上述熔融物中含有金屬鋁,填寫下列表格:
①所用試劑 | ______ |
②實驗操作及現象 | ______ |
③有關反應的化學方程式 | ______ |
(3)欲在常溫下溶解該熔融物,下列試劑中最好選用______(填序號),理由是_________________________。
a.濃硫酸 b.稀硫酸 c.硫酸鋅溶液d. ![]() 溶液
溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用已知物質的量濃度的HCl來測定未知物質的量濃度的NaOH溶液時,選甲基橙作指示劑,使所測氫氧化鈉溶液的濃度偏低的是( )
A.錐形瓶用蒸餾水沖洗后未用待測液潤洗
B.讀取鹽酸體積時,開始仰視讀數,滴定結束時俯視讀數
C.終點時,有一滴標準液掛在滴定管尖嘴處未滴入錐形瓶
D.裝標準液的滴定管滴定前尖嘴處有氣泡,滴定后氣泡消失
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W四種元素的部分信息如下表所示。
元素 | X | Y | Z | W |
相關 信息 | 短周期元素,最高化合價為+7價 | 基態原子中,電子占據的最高能層符號為L,最高能級上只有兩個自旋方向相同的電子 | 核外電子共有15種運動狀態 | 能與X形成兩種常見化合物WX2、WX3,酚遇WX3溶液能發生顯色反應 |
回答下列問題:
(1)W的基態原子電子排布式為___,X、Y、Z三種元素電負性由大到小的順序為___(用具體的元素符號填寫)。
(2)化合物YX4、ZX3、ZX5(氣態或液態時)中,中心原子的軌道類型不是sp3雜化的是___ (填化學式,下同),分子構型是正四面體的是___,ZX3屬于___(極性分子、非極性分子)。
(3)已知WX3的熔點:306℃,沸點:319℃,則WX3的晶體類型為___。
(4)Z原子的價電子軌道表示式為___。
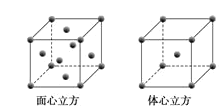
(5)W元素的單質晶體在不同溫度下有兩種堆積方式,晶胞分別如圖所示。在面心立方晶胞中W原子的配位數為___;若W的原子半徑為rcm,阿伏加德羅常數為NA,則其體心立方晶體的密度可表示為___gcm-3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從海帶中提取碘,可經過以下實驗步驟完成。下列有關說法正確的是( )

A.灼燒過程中使用的玻璃儀器有酒精燈、燒杯、玻璃棒
B.氧化過程中發生反應的離子方程式為![]()
C.檢驗碘單質時,可選用淀粉,若淀粉變藍說明海帶中一定含有碘單質
D.分液時,先打開活塞放出下層液體,再關閉活塞,從上口倒出上層液體
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com