
| A. | 向氯化銀的濁液中加入氯化鈉溶液,氯化銀的溶解度減小 | |
| B. | 向2.0×10-1mol/L的K2CrO4溶液中加入等體積的2.0×10-1mol/LAgNO3溶液,則有Ag2CrO4沉淀生成 | |
| C. | 將一定量的AgCl和Ag2CrO4固體棍合物溶于蒸餾水中,充分溶解后,靜置,上層清液中Cl-的物質的量濃度最大 | |
| D. | 將0.001 mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001 mol/L的K2CrO4溶液,則先產生AgCl沉淀 |
分析 A、據AgCl的Ksp分析,加入NaCl,氯離子濃度增大,AgCl溶解度減小;
B、計算溶液中的Q與Ksp(Ag2CrO4)=1.12×10-12 mol3•L-3比較;
C、AgCl和Ag2CrO4固體混合物溶于蒸餾水中,AgCl和Ag2CrO4都會產生銀離子;
D、根據Ksp(AgCl)、Ksp(Ag2CrO4),計算Cl-、CrO42-開始沉淀時c(Ag+),需要c(Ag+)小的先沉淀.
解答 解:A、向氯化銀的濁液中加入氯化鈉溶液,氯離子濃度增大,沉淀的溶解平衡逆向移動,AgCl溶解度減小,故A正確;
B、Q=c2(Ag+)×c(CrO42-)=$(\frac{2.0×1{0}^{-4}}{2})^{2}×(\frac{2.0×1{0}^{-4}}{2})$=1.0×10-12<Ksp(Ag2CrO4)=1.12×10-12 mol3•L-3,所以沒有沉淀生成,故B錯誤;
C、AgCl和Ag2CrO4固體混合物溶于蒸餾水中,AgCl和Ag2CrO4都會產生銀離子,所以銀離子濃度最大,故C錯誤;
D、由Ksp(AgCl)、Ksp(Ag2CrO4),則當Cl-開始沉淀時c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=1.56×10-10mol/L,當CrO42-開始沉淀時c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$=4.36×10-5 mol/L,故先產生AgCl沉淀,故D正確;
故選AD.
點評 本題考查溶度積常數的有關計算、判斷離子是否完全,沉淀等問題,綜合性強,難度較大.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 3-甲基戊烷
3-甲基戊烷 2,2,3-三甲基丁烷
2,2,3-三甲基丁烷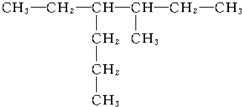 3-甲基-4-乙基庚烷
3-甲基-4-乙基庚烷 2,5-二甲基-3-乙基戊烷
2,5-二甲基-3-乙基戊烷 3,4-二甲基-5-乙基辛烷
3,4-二甲基-5-乙基辛烷 3-甲基-4-乙基己烷.
3-甲基-4-乙基己烷.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:1 | B. | 5:4 | C. | 4:3 | D. | 5:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
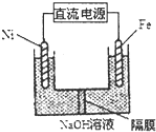
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 溫度℃) | 20 | 40 | 60 | 100 |
| 溶解度(g) | 5.0 | 8.7 | 14.8 | 40.2 |
| 物質 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 3.2 | 5.2 | 9.7 | 12.4 |

| 化學式 | H2CO3 | CH3COOH |
| 電離常數 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com