
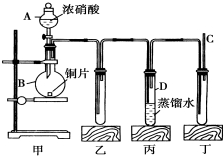
 某學校化學學習小組為探究二氧化氮的性質,按如圖所示裝置進行實驗.
某學校化學學習小組為探究二氧化氮的性質,按如圖所示裝置進行實驗.分析 (1)根據實驗室儀器名稱書寫;燒瓶中發生濃硝酸與銅片的氧化還原反應,書寫出化學方程式;
(2)銅和濃硝酸在裝置甲中反應生成紅棕色的二氧化氮氣體進入乙裝置,在丙裝置中二氧化氮和水發生反應,根據反應中電子得失守恒可判斷氧化劑和還原劑的物質的量之比,據此分析解答;
(3)在常溫下一氧化氮易被氧氣氧化;
解答 解:(1)裝置甲中盛放濃硝酸的儀器A的名稱是分液漏斗;燒瓶中發生濃硝酸與銅片的氧化還原反應,化學方程式為:Cu+4HNO3(濃)═Cu(NO3)2+2NO2↑+2H2O,
故答案為:分液漏斗;Cu+4HNO3(濃)═Cu(NO3)2+2NO2↑+2H2O;
(2)銅和濃硝酸在裝置甲中反應Cu+4HNO3(濃)═Cu(NO3)2+2NO2↑+2H2O,生成紅棕色的二氧化氮氣體進入乙裝置,所以裝置乙中出現的現象為生成紅棕色氣體;二氧化氮經導管進入丙裝置和水反應3NO2+H2O═2H++2NO3-+NO,所以裝置丙中出現的現象蒸餾水中有氣泡產生,生成無色氣體,此反應中氧化劑和還原劑的物質的量之比是1:2,
故答案為:生成紅棕色氣體;蒸餾水中有氣泡產生,生成無色氣體;3NO2+H2O═2H++2NO3-+NO;1:2;
(3)因在常溫下一氧化氮易被氧氣氧化成紅腫色的二氧化氮,所以為了探究NO的還原性,可以在裝置丁的導氣管C中通入氧氣,
故答案為:氧氣;
點評 本題考查了物質性質的分析判斷和實驗設計驗證,主要是銅和濃硝酸反應生成的二氧化氮氣體的性質檢驗設計,以及Fe3+、NO2、NO的性質檢驗,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 按照系統命名法,烴分子 的名稱為2,3-二甲基-3-乙基戊烷 的名稱為2,3-二甲基-3-乙基戊烷 | |
| B. | 雞蛋白、大豆蛋白等蛋白質可溶于水,在這些蛋白質溶液中加入(NH4)2SO4或Na2SO4的濃溶液,可使蛋白質的溶解度降低而析出 | |
| C. | 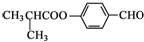 可發生加成反應、取代反應、氧化反應 可發生加成反應、取代反應、氧化反應 | |
| D. | 有機物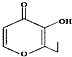 (俗稱“一滴香”)的一種含苯環的同分異構體能發生銀鏡反應 (俗稱“一滴香”)的一種含苯環的同分異構體能發生銀鏡反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②③⑤⑦⑧ | B. | ①④⑥⑦ | C. | ①②③⑤⑦ | D. | ④⑥⑦⑧ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO中混有CO2(NaOH溶液) | B. | H2中混有HCl(NaOH溶液) | ||
| C. | NO中混有NO2(水) | D. | CO2中混有HCl(飽和Na2CO3溶液) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入反應物,使活化分子的百分數增加,反應速率加快 | |
| B. | 有氣體參加的化學反應,若增大壓強(即縮小體積)可增加活化分子的百分數使化學反應速率增大 | |
| C. | 升高溫度使化學反應速率增大的主要原因是增加了反應物分子中活化分子的百分數 | |
| D. | 活化分子間發生的碰撞為有效碰撞 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
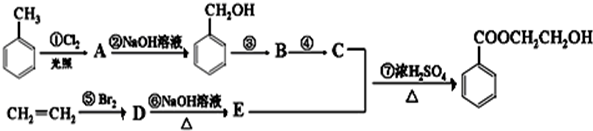
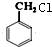 .
.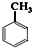 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl寫出第⑥步反應的化學方程式:BrCH2CH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaBr.
+HCl寫出第⑥步反應的化學方程式:BrCH2CH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaBr.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>① | |
| B. | 將0.5 mol/L的Na2CO3溶液與amol/L的NaHCO3溶液等體積混合,c(Na+)<c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 10mL0.1mol/LCH3COOH溶液與20mL0.1mol/LNaOH溶液混合后,溶液中離子濃度關系:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) | |
| D. | 25℃某濃度的NaCN溶液的pH=d,則其中由水電離出的c(OH-)=10-dmol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.15mol | B. | 0.3mol | C. | 0.05mol | D. | 無法計算 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com