
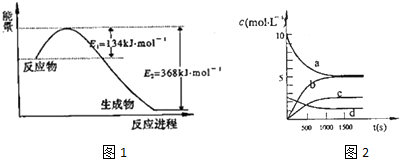
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
分析 (1)根據能量變化圖,反應熱等于=正反應的活化能減去逆反應的活化能,結合熱化學方程式的書寫規則書寫;利用寫出的熱化學方程式,結合給出的熱化學方程式,利用蓋斯定律,獲得所需熱化學方程式的焓變;
(2)①化學平衡常數為生成物濃度系數次冪的乘積與反應物濃度系數次冪乘積的比值;溫度低,化學平衡常數大,則正反應放熱;
②NO2轉化率為已轉化的NO2物質的量與起始物質的量的百分比;增大NO2的轉化率,促進反應的正向移動即可;
③N2O5為生成物且反應為可逆反應,反應不可能進行到底,以此判斷表示N2O5的濃度的變化曲線;求出NO2的反應速率,利用反應速率之比等于計量數之比,求得O2的平均速率.
解答 解:(1)該反應的焓變△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以熱化學方程式為:①NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1;②N2 (g)+2NO2 (g)?4NO(g)△H=+292.3kJ•mol-1,反應①×2-②,可得到:2NO(g)+2CO(g)?N2(g)+2CO2(g),△H=-760.3kJ•mol-1;
故答案為:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1;-760.3kJ•mol-1;
(2)①化學平衡常數為生成物濃度系數次冪的乘積與反應物濃度系數次冪乘積的比值,即K=$\frac{{c}^{2}({N}_{2}{O}_{5})}{{c}^{4}(N{O}_{2})•c({O}_{2})}$;溫度低,化學平衡常數大,則正反應放熱,
故答案為:$\frac{{c}^{2}({N}_{2}{O}_{5})}{{c}^{4}(N{O}_{2})•c({O}_{2})}$;放熱;
②轉化的NO2的物質的量為20mol-10.08mol=9.92mol,轉化率為$\frac{9.92mol}{20mol}×100%$=49.6%;
A、該反應為放熱反應,降低溫度,化學平衡向右移動,故A正確;
B、反應氣體濃度不變,化學平衡不移動,故B錯誤;
C、再充入NO2,轉化的物質的量增大,但是起始的物質的量增大較多,轉化率降低,故C錯誤;
D、加入氣體比例與原平衡NO2的轉化率相同,由于加入氣體后,體系壓強增大,NO2的轉化率增大,故D正確;
故答案為:49.6%;AD;
③N2O5為生成物濃度增大,反應為可逆反應,不可能進行到底,即N2O5的濃度不可能達到5mol/L;NO2從0~500s的化學反應速率為:$\frac{(20-13.96)mol}{2L•500s}$=6.04×10-3mol•L-1•s-1,則O2速率為$\frac{6.04×10-3mol•{L}^{-1}•{s}^{-1}}{4}$=1.51×10-3mol•L-1•s-1,
故答案為:c;1.51×10-3mol•L-1•s-1.
點評 本題綜合考查化學平衡影響因素、化學平衡的計算,為高考常見題型和高頻考點,側重于學生的分析、計算能力的考查,題目計算量較大,難度較大,關鍵是構建平衡建立的等效途徑,注意從正、逆不同方向建立的等效平衡轉化率、反應熱的關系.


科目:高中化學 來源: 題型:選擇題
| A. | 1.8×10-7 mol•L-1,2 | B. | 1×10-7 mol•L-1,2 | ||
| C. | 1.8×10-7 mol•L-1,3 | D. | 1×10-7 mol•L-1,3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

| 反應時間/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
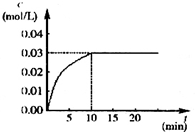 在某一容積為5L的密閉容器內,加入 0.2mol的CO和0.2mol的H2O,在催化劑存在和800℃的條件下加熱,發生如下反應:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反應中CO2的濃度隨時間變化情況如下圖:
在某一容積為5L的密閉容器內,加入 0.2mol的CO和0.2mol的H2O,在催化劑存在和800℃的條件下加熱,發生如下反應:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反應中CO2的濃度隨時間變化情況如下圖:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗 | 現象 | 結論 |
| A | 加熱莫爾鹽(NH4)2Fe(SO4)2•6H2O,產生的氣體通過裝有無水硫酸銅的干燥管 | 干燥管中白色粉末先變成天藍色,后又變成深藍色 | 溫度較低時莫爾鹽分解產生水蒸氣,溫度稍高時分解產物中有氨氣 |
| B | 向KMnO4溶液中通入SO2氣體 | 溶液紫紅色褪去 | SO2具有漂白性 |
| C | 向某溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出現白色沉淀 | 溶液中一定含有SO42- |
| D | 取1mL 20%的蔗糖溶液,加入3~5滴稀硫酸.水浴加熱5min后取少量溶液,加入少量新制Cu(OH)2,加熱4min | 未產生磚紅色沉淀 | 蔗糖不能水解生成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鉀元素化合價降低 | B. | Fe(OH)3發生氧化反應 | ||
| C. | 該反應是置換反應 | D. | Cl2是還原劑 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com