
| A. | Ba(OH)2溶液中加入少量的NaHSO4溶液中:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| B. | SO2通入NaCO溶液中:SO2+ClO-+2OH-=SO42-+Cl-+H2O | |
| C. | (NH4)2Fe(SO4)2溶液與過量NaOH溶液反應:Fe2++2OH-=Fe(OH)2↓ | |
| D. | 用H2O2從酸化的海帶灰浸出液中提取I2:H2O2+2I-=I2+2OH- |
分析 A.向Ba(OH)2溶液中加入少量的NaHSO4溶液,二者以1:1反應,生成硫酸鋇、氫氧化鈉和水;
B.反應中SO2被NaClO氧化為SO42-;
C.(NH4)2Fe(SO4)2溶液與過量NaOH溶液反應生成氫氧化亞鐵、氨水和硫酸鈉;
D.酸性條件下產物中沒有氫氧根離子,應該生成水.
解答 解:A.向Ba(OH)2溶液中加入少量的NaHSO4溶液,二者以1:1反應,生成硫酸鋇、氫氧化鈉和水,其離子方程式為:Ba2++OH-+H++SO42-=BaSO4↓+H2O,故A錯誤;
B.反應中SO2被NaClO氧化為SO42-,其離子方程式為:SO2+ClO-+2OH-=SO42-+Cl-+H2O,故B正確;
C.(NH4)2Fe(SO4)2溶液與過量NaOH溶液反應生成氫氧化亞鐵、氨水和硫酸鈉,其離子方程式為:Fe2++2NH4++4OH-=Fe(OH)2↓+2NH3•H2O,故C錯誤;
D.酸性條件下產物中沒有氫氧根離子,應該生成水,則用H2O2從酸化的海帶灰浸出液中提取I2離子方程式為:H2O2+2H++2I-=I2+2H2O,故D錯誤.
故選B.
點評 本題考查離子反應方程式的書寫,明確發生的化學反應是解答本題的關鍵,并熟悉離子反應方程式的書寫方法來解答,題目難度不大


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
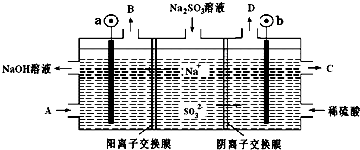
| A. | b電極上的主反應是 SO32--2e-+H2O═SO42-+2H+ | |
| B. | 若D是混合氣體,則可能含有SO2、O2等成分 | |
| C. | a 電極發生還原反應,當有1mol Na+通過陽離子交換膜時,a極生成11.2L氣體 | |
| D. | A溶液是稀NaOH溶液,作用是增強溶液的導電性;C是較濃的硫酸溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 發展核電、煤中加入生石灰、利用二氧化碳制造全降解塑料都能有效減少環境污染 | |
| B. | 物質變化中炭化、鈍化、皂化、酯化、熔化都屬于化學變化 | |
| C. | 氫鍵、分子間作用力、離子鍵和共價鍵均為微粒間的相互作用力 | |
| D. | 農業廢棄物、城市工業有機廢棄物及動物糞便中都蘊藏著豐富的生物質能 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 正、逆反應速率都減小,平衡不移動 | |
| B. | 正、逆反應速率都減小,平衡向正反應方向移動 | |
| C. | 正反應速率增大,逆反應速率減小,平衡向正反應方向移動 | |
| D. | 正反應速率減小,逆反應速率增大,平衡向逆反應方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 粒子組 | 評價及離子方程式 |
| A | K+、Al3+、SO42-、NO3- | 能大量共存于同一溶液中 |
| B | H+、CH3CHO、SO42-、MnO4- | 能大量共存于同一溶液中 |
| C | NH4+、Fe3+、SCN-、Cl- | 不能大量共存,Fe3++3SCN-=Fe(SCN)3↓ |
| D | Na+、K+、HCO3-、OH- | 不能大量共存,HCO3-+OH-=H2O+CO2↑ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,17g氨氣分子所含質子數為10NA | |
| B. | 1mol CL2參加反應,轉移電子數一定為2N | |
| C. | 常溫常壓下,22.4 L C02分子中含有2NA個σ鍵和2NA個1π鍵 | |
| D. | 1 L 0.01 mol.L-1的Na2CO3溶液中含有0.01NA個CO2- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 光化學煙霧是氮氧化物受紫外線照射后與空氣中的一些碳氫化合物作用后生成的一種有毒煙霧 | |
| B. | 以糧食為原料釀酒過程的變化包括糧食→淀粉→葡萄糖→乙醇 | |
| C. | 航天飛機上使用的隔熱陶瓷瓦,大多是以碳纖維做增強體的新型復合材料 | |
| D. | 綠色化學的核心是應用化學原理對環境污染進行治理 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com