
某消毒液的主要成分為 NaClO(混有少量NaCl),請用相應的化學用語來解釋下列事實。
(1)該消毒液可用NaOH 溶液吸收Cl2 制備,化學方程式為_______________________。
(2)該消毒液的pH 約為12,離子方程式為__________________________。
(3)向FeSO4 溶液中滴入少量該溶液,溶液顏色變成棕黃色,反應的離子方程式為______________。
(4)該消毒液不能與潔廁靈(主要成分為濃鹽酸)混用,否則會產生中毒危險。每產生1 mol Cl2(標準狀況下),轉移電子個數約為________________ 。
科目:高中化學 來源:2015-2016學年山西省高二上學期第一次月考化學試卷(解析版) 題型:選擇題
下列說法正確的是
A.可逆反應不可以自發進行
B.催化劑可以加塊反應速率,也可增大反應物的轉化率
C.當有多個反應參加時,使用催化劑,可增加目標產物的產率
D.H2與O2點燃生成H2O,H2O電解產生H2與O2,說明該反應可逆
查看答案和解析>>
科目:高中化學 來源:2016屆吉林省高三上學期二次模擬測試理綜化學試卷(解析版) 題型:填空題
【化學一一選修5:有機化學基礎】(15分)
某藥物可通過以下方法合成:

注:非諾洛芬是一種治療類風濕性關節炎的藥物。請回答下列問題:
(1)非諾洛芬中的含氧官能團為 和 (填名稱)。
(2)反應①中加入的試劑X的分子式為C8H8O2,X的結構簡式為 。
(3)在上述五步反應中,屬于取代反應的是 (填序號)。
(4)B的一種同分異構體滿足下列條件:
Ⅰ.能發生銀鏡反應,其水解產物之一能與FeCl3溶液發生顯色反應。
Ⅱ.分子中有6種不同化學環境的氫,且分子中含有兩個苯環。
寫出該同分異構體的結構簡式: 。
(5)根據已有知識并結合相關信息,寫出以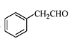 為原料制備
為原料制備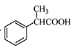 的合成路線流程圖(無機試劑任用)。合成路線流程圖示例如下:
的合成路線流程圖(無機試劑任用)。合成路線流程圖示例如下:

查看答案和解析>>
科目:高中化學 來源:2015-2016學年山東省高二上學期第一次月考化學試卷(解析版) 題型:填空題
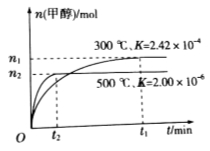
(8分)能源問題是人類社會面臨的重大課題,甲醇是一種可再生能源,具有開發和應用的廣闊前景,研究甲醇具有重要意義。
(1)用CO合成甲醇的反應為 。


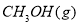 ;在容積為1L的密閉容器中分別充入1mol CO和2mol H2,實驗測得甲醇的物質的量和溫度、時間的關系曲線如圖所示。則該正反應的
;在容積為1L的密閉容器中分別充入1mol CO和2mol H2,實驗測得甲醇的物質的量和溫度、時間的關系曲線如圖所示。則該正反應的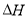 (填“<”“>”或“=”)0。
(填“<”“>”或“=”)0。
(2)利用工業廢水中的CO2可制取甲醇,其反應為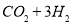

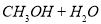 。
。
①已知下列反應的能量變化如圖所示:
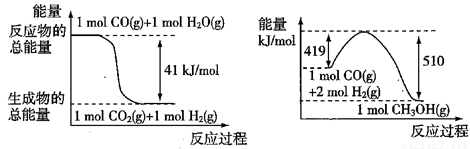
由二氧化碳和氫氣制備甲醇的熱化學方程式為 。
②為探究用CO2來生產燃料甲醇的反應原理,現進行如下實驗:在一恒溫恒容密閉容器中,充入1mol CO2和3mol H2,進行上述反應。測得CO2和CH3OH(g)的濃度隨時間變化如圖1所示,從反應開始到平衡,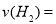 .
.
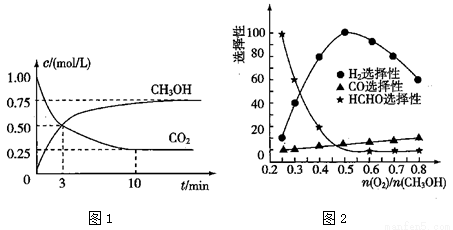
(3)工業上可利用甲醇部分氧化法制取氫氣。在一定溫度下以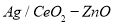 為催化劑時原料氣比例對反應的選擇性(選擇性越大,表示生成的該物質越多)影響關系如圖2所示。在制備H2時最好控制
為催化劑時原料氣比例對反應的選擇性(選擇性越大,表示生成的該物質越多)影響關系如圖2所示。在制備H2時最好控制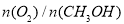 = 。
= 。
查看答案和解析>>
科目:高中化學 來源:2016屆安徽省安慶市高三上學期第一次質檢化學試卷(解析版) 題型:簡答題
工業上可利用“甲烷蒸氣轉化法生產氫氣”,反應為:
CH4(g)+H2O(g)  CO(g)+3H2(g)
CO(g)+3H2(g)
已知溫度、壓強和水碳比[n(H2O)/n(CH4)]對甲烷平衡含量(%)的影響如下圖1:

圖1 (水碳比為3) 圖2 (800℃)
(1)CH4(g)+H2O(g)  CO(g)+3H2(g)。的
CO(g)+3H2(g)。的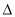 H 0(填“>”或“<”);若在恒溫、恒壓時,向該平衡體系中通入氦氣平衡將 移動(填“向正應方向”、“向逆反應方向”或“不”)。
H 0(填“>”或“<”);若在恒溫、恒壓時,向該平衡體系中通入氦氣平衡將 移動(填“向正應方向”、“向逆反應方向”或“不”)。
(2)溫度對該反應的反應速率和平衡移動的影響是 。
(3)其他條件不變,請在圖2中畫出壓強為2MPa時,甲烷平衡含量(%)與水碳比之間關系曲線。(只要求畫出大致的變化曲線)
(4)已知:在700℃,1MPa時,1mol CH4與1mol H2O在2L的密閉容器中反應,6分鐘達到平衡,此時CH4的轉化率為80%,求這6分鐘H2的平均反應速率和該溫度下反應的平衡常數是多少?(寫出計算過程,結果保留小數點后一位數字。)
查看答案和解析>>
科目:高中化學 來源:2016屆吉林省扶余市高三上學期第一次月考化學試卷(解析版) 題型:填空題
(1)(8分)某無色溶液含下列8種離子中某幾種:Na+、H+、Mg2+、Ag+、Cl-、OH-、
HCO3-、NO3-。已知該溶液可與Al2O3反應,則:
① 若溶液與Al2O3反應,有Al3+生成,則溶液一定有________,一定不含有________。
② 若溶液與 Al2O3反應,有AlO2-生成,則溶液一定有________,可能含有________。
(2)(5分)有五瓶損壞標簽的試劑,分別盛有AgNO3溶液、稀硝酸、鹽酸、氯化鋇溶液、碳酸鉀溶液,為了確定各瓶中是什么試劑,將它們任意編號為A、B、C、D、E,
用小試管各盛少量多次進行兩兩混合反應,反應現象為:A與B、A與E產生沉淀,B與D、B與E產生沉淀,C與E、D與E產生氣體,而C與D無反應現象。
由此,可判定各試劑瓶中所盛試劑為:
A________,B________,C________,D________,E________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年吉林省高二上學期第一次月考化學試卷(解析版) 題型:實驗題
用中和滴定法測定燒堿的純度(燒堿中的雜質不和酸反應),請根據實驗回答:
(1)將稱量好的8.8g燒堿樣品配制成500mL待測液,配制過程使用的主要儀器除500mL容量瓶、量筒、燒杯、膠頭滴管外,還有一種必須使用的儀器是___________。
(2)用_______式滴定管量取10.00mL待測液于錐形瓶中,滴入幾滴酚酞。
(3)用0.20mol•L-1的標準鹽酸滴定待測液,判斷滴定終點的現象是:_________。
(4)如果實驗操作正確,從滴定開始到結束,溶液中的離子濃度關系可以出現的是_______(填答案字母序號)
A.c(Na+)>c(Cl-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(Cl-)>c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-)
D.c(Cl-)+c(Na+)>c(OH-)+c(H+)
(5)根據下列數據計算,c(NaOH)_______mol/L,燒堿的純度為________%(保留整數)
滴定次數 | 待測液體積(mL) | 標準鹽酸體積(mL) | |
滴定前讀數(mL) | 滴定后讀數(mL) | ||
第一次 | 10.00 | 0.60 | 20.50 |
第二次 | 10.00 | 3.00 | 23.10 |
(6)經過分析發現,本次實驗的測定結果比燒堿的實際純度偏高,造成誤差的可能原因是_________(填答案字母序號,錯選此題為0分)
A.滴定前平視,滴定后俯視
B.未用標準液潤洗滴定管
C.用待測液潤洗錐形瓶
D.不小心將標準液滴在錐形瓶外面
E.滴定接近終點時,用少量蒸餾水沖洗錐形瓶內壁
F.滴定前尖嘴有氣泡,滴定后消失
查看答案和解析>>
科目:高中化學 來源:2016屆山西省校高三上學期階段性考試化學試卷(解析版) 題型:選擇題
能正確表示下列反應的離子方程式的是
A.鋁與硫酸銅溶液反應:Al+Cu2+=Al3++Cu
B.碳酸鋇溶于稀硝酸:CO32-+2H+=H2O+CO2↑
C.鐵與稀鹽酸反應:Fe+2H+=Fe3++H2↑
D.醋酸除水垢:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山西省高二上期中考試化學試卷(解析版) 題型:填空題
(每空2分,共10分)鐵元素是重要的金屬元素,單質鐵在工業和生活中使用得最為廣泛。鐵還有很多重要的化合物及其化學反應。
如鐵與水反應:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H
(1)上述反應的平衡常數表達式K=_____________。
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s) △H1=-1118.4kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H2=-483.8 kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) △H3=-571.8 kJ·mol-1
則△H=_____________。
(3)在t℃時,該反應的平衡常數K=16,在2L恒溫恒容密閉容器甲和乙中,分別按下表所示加入物質,反應經過一段時間后達到平衡。
Fe | H2O(g) | Fe3O4 | H2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中H2O的平衡轉化率為_____________(結果保留一位小數)。
②下列說法正確的是_____________(填編號)
A.若容器壓強恒定,則反應達到平衡狀態
B.若容器內氣體密度恒定,則反應達到平衡狀態
C.甲容器中H2O的平衡轉化率大于乙容器中H2O的平衡轉化率
D.增加Fe3O4就能提高H2O的轉化率
(4)若將(3)中裝置改為恒容絕熱(不與外界交換能量)裝置,按下表充入起始物質,起始時與平衡后的各物質的量見表:
Fe | H2O(g) | Fe3O4 | H2 | |
起始/mol | 3.0 | 4.0 | 0 | 0 |
平衡/mol | m | n | p | q |
若在達平衡后的裝置中繼續加入A、B、C三種狀況下的各物質,見表:
Fe | H2O(g) | Fe3O4 | H2 | |
A/mol | 3.0 | 4.0 | 0 | 0 |
B/mol | 0 | 0 | 1 | 4 |
C/mol | m | n | p | q |
當上述可逆反應再一次達到平衡狀態后,上述各裝置中H2的百分含量按由大到小的順序排列的關系是___________(用A、B、C表示)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com