
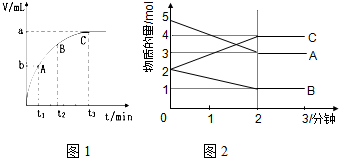
 合成氨工業對國民經濟和社會發展具有重要的意義.對于密閉容器中的反應:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)隨時間變化的關系如圖所示.下列敘述正確的是( )
合成氨工業對國民經濟和社會發展具有重要的意義.對于密閉容器中的反應:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)隨時間變化的關系如圖所示.下列敘述正確的是( )| A. | 點a的正反應速率比點b的小 | |
| B. | 點c處反應達到平衡 | |
| C. | 點d(t1時刻)和點e(t2時刻)處n(N2)不一樣 | |
| D. | 其他條件不變,773K下反應至t1時刻,n(H2)比圖中d點的值大 |
分析 在N2(g)+3H2(g)?2NH3(g)反應中,隨著反應的進行,反應物的物質的量逐漸減少,生成物的物質的量逐漸增多,當達到平衡狀態時,正逆反應速率相等,反應物的生成物的物質的量不再改變,曲線為水平直線,升高溫度平衡逆向移動,以此判斷題中各項.
解答 解:A、從a點到b點,氫氣的物質的量在逐漸減少,氫氣的物質的量濃度在逐漸減少,所以正反應的反應速率在逐漸降低,即點a的正反應速率比點b的大,故A錯誤;
B、由圖可知,c點反應物和生成物物質的量仍在變化,反應沒有達到平衡狀態,故B錯誤;
C、d點和e點都處于平衡狀態,n(N2)不變,即d點和e點n(N2)相等,故C錯誤;
D、已知該反應正方向為放熱反應,其他條件不變,773K下反應至t1時刻,由于溫度升高平衡向逆方向移動,則n(H2)增大,所以n(H2)比上圖中d點的值大,故D正確;
故選D.
點評 本題考查化學平衡圖象問題,題目難度不大,注意分析圖象中各物理量的變化曲線,把握平衡狀態的特征為解答該題的關鍵.


科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4LHF分子中所含的原子數約為2NA | |
| B. | 1mol冰中,平均所含氫鍵的數目為NA | |
| C. | 在氧化還原反應中,1molH2O2轉移的電子數為2NA | |
| D. | 13gCnHn分子中最多含C-C數為1.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| MnO2 | 觸摸試管情況 | 觀察結果 | 反應完成所需的時間 |
| 粉末狀 | 很燙 | 劇烈反應,帶火星的木條復燃 | 3.5 min |
| 塊狀 | 微熱 | 反應較慢,火星紅亮但木條未復燃 | 30min |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 目前,汽車廠商常利用催化技術將尾氣中的NO和CO轉化成CO2和N2,化學方程式如下:2NO+2CO$\stackrel{催化劑}{?}$2CO2+N2.為研究如何提高該轉化過程反應速率,某課題組進行了以下實驗探究.
目前,汽車廠商常利用催化技術將尾氣中的NO和CO轉化成CO2和N2,化學方程式如下:2NO+2CO$\stackrel{催化劑}{?}$2CO2+N2.為研究如何提高該轉化過程反應速率,某課題組進行了以下實驗探究.| 實驗編號 | 實驗目的 | T/℃ | NO初始濃度 mol/L | CO初始濃度 mol/L | 同種催化劑的比表面積m2/g |
| Ⅰ | 為以下實驗作參照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究催化劑比表面積對尾氣轉化速率的影響 | 280 | 6.50×10-3 | 4.00×10-3 | 120 |
| Ⅲ | 探究溫度對尾氣轉化速率的影響 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 、
、 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 請按要求回答下列問題:
請按要求回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | X、Y、Z元素分別為N、P、O | |
| B. | 白格中都是主族元素,灰格中都是副族元素 | |
| C. | 原子半徑:Z>X>Y | |
| D. | X、Y、Z的氣態氫化物中最穩定的是:X的氫化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com