
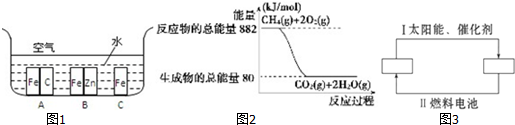
分析 (1)金屬腐蝕的速度:原電池的負極金屬>金屬的化學腐蝕>有保護措施的腐蝕;
(2)根據圖示寫出1 mol CH4完全燃燒生成氣態水時的熱化學方程式,然后結合每摩爾水由氣態變為液態時放出44kJ,根據蓋斯定律來解答;
(3)①分析轉化關系可知氫能源循環體系圖中,燃料電池是氫氣和氧氣反應燃燒生成水的過程,水在太陽能和催化劑作用下分解有生成氧氣和氫氣;
②過程Ⅱ是發生的原電池反應;
③根據題中信息綠色化學的要求:反應物全部轉化為期望的產物,使原子的利用率達到100%,可知化合反應、加成反應符合綠色化學的要求;需要的條件越簡單,越節能.
解答 (1)解:鐵處于A的環境中做原電池的負極,腐蝕速率較快,鐵處于B的環境中做原電池的正極,被保護,腐蝕速率很慢,鐵處于C的環境中的金屬鐵發生吸氧腐蝕,速度較慢.
故答案為:A>C>B;
(2)由圖知1 mol CH4完全燃燒生成氣態水時放出熱量為(882-80)kJ=802 kJ,
熱化學方程式為:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802 kJ/mol①
又知每摩爾水由氣態變為液態時放出44kJ:H2O(g)=H2O(l)△H=-44KJ/mol②
根據蓋斯定律,將①+②×2可得:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=(-802 kJ/mol)+2×(-44KJ/mol)=-890 kJ/mol
故答案為:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol;
(3)①轉化關系可知氫能源循環體系圖中,燃料電池是氫氣和氧氣反應燃燒生成水的過程,水在太陽能和催化劑作用下分解有生成氧氣和氫氣,兩個框中的X、Y為循環過程中反應物和生成物的分子式為:左邊為H2O;右邊為H2、O2;
故答案為:左邊為H2O;右邊為H2、O2;
②過程Ⅱ是發生的原電池反應,能量變化是化學能轉化為電能的過程;
故答案為:化學;電;
③C需要的條件是自然界中存在的太陽光,其他反應需要特定的催化劑,所以C最節能,根據題中信息綠色化學的要求:反應物全部轉化為期望的產物,使原子的利用率達到100%,可知C是化合反應,原子利用率最高.
故答案為:C;B.
點評 本題考查學生金屬的腐蝕速率快慢比較、蓋斯定律的應用和反應熱的求算、化學反應過程中能量變化形式、原電池原理的分析應用等知識,難度不大,綜合性強.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
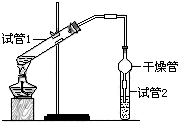 乙酸乙酯是重要的有機合成中間體,廣泛應用于化學工業.為證明濃硫酸在實
乙酸乙酯是重要的有機合成中間體,廣泛應用于化學工業.為證明濃硫酸在實| 實驗 編號 | 試管1中的試劑 | 試管2中試劑 | 測得有機層的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L濃硫酸 | 飽和碳酸鈉溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、鹽酸 | 1.2 |
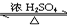 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②④①③ | B. | ②①④③ | C. | ①②③④ | D. | ①②④③ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

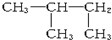



查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質量數相同的不同原子,其化學性質一定相同 | |
| B. | 質子數相同的原子,其核外電子排布也相同 | |
| C. | 金屬性越強,其原子在反應中越易失去電子 | |
| D. | 非金屬性越強,其陰離子越難失去電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 ,其合成過程中涉及的反應類型分別是( )
,其合成過程中涉及的反應類型分別是( )| A. | ①③ | B. | ①② | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯與硝酸在加熱時發生取代反應,甲苯與硝酸在常溫下就能發生取代反應 | |
| B. | 乙醇、苯酚都有羥基,但是電離常數不同 | |
| C. | 苯酚無需催化劑即能與溴水發生取代反應 | |
| D. | 1 mol甲苯能與3 mol H2發生加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
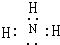 ,實驗室制取該氫化物的化學方程式為2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
,實驗室制取該氫化物的化學方程式為2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O. .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com