

| A. | 反應方程式中的x=1,30min時改變條件后,A的轉化率將變減小 | |
| B. | 前30 min內 A的反應速率為0.05 mol/(L•min) | |
| C. | 20至40 min內表示處于平衡狀態,該反應為放熱反應 | |
| D. | 30 min時改變的條件是加入負催化劑,40 min時改變的條件是升高溫度 |
分析 A、濃度變化量之比等于系數之比,據此確定系數x,根據化學平衡的移動和轉化率的關系來回答;
B、根據數據計算前20 min內的反應速率,但是20-30min內,改變了外界條件會引起速率的變化;
C、根據平衡狀態的特征判斷反應是否平衡,根據外界條件對平衡移動、反應速率的影響來判斷;
D、根據圖示內容結合外界條件對平衡移動、反應速率的影響來判斷.
解答 解:A、反應在20min達到了平衡,c(B)=1.0mol/L,c(C)=2.0mol/L,△c(C)=2.0mol/L,△c(B)=1.0mol/L,濃度變化量之比等于系數之比,所以x=1,30min時改變條件后,化學平衡不移動,A的轉化率將不變,故A錯誤;
B、前20 min內,△c(C)=2.0mol/L,△c(B)=1.0mol/L,△c(A)=1.0mol/L,前20 min內A的反應速率為=$\frac{1.0mol/L}{20min}$=0.05 mol/(L•min),但是20-30min之間,由于改變條件,化學反應速率發生變化,所以,前30 min內 A的反應速率不再是0.05 mol/(L•min),故B錯誤;
C、20至40 min內,化學反應速率不再變化,所以表示處于平衡狀態,40min時正逆反應速率都增大,由于該反應是體積不變的反應,所以不可能增大壓強,只能是升高了溫度;由于升高溫度后,逆反應速率大于正反應速率,說明該反應為放熱反應,故C正確;
D、30 min時,改變的條件,化學平衡不移動,但是正逆反應速率減慢,由于該反應是體積不變的反應,可能減小壓強,或是加入負催化劑,40min時正逆反應速率都增大,由于該反應是體積不變的反應,所以不可能增大壓強,只能是升高了溫度,故D正確.
故選CD.
點評 該題涉及化學平衡移動的影響因素和化學反應速率的有關計算.需讀懂化學平衡的圖象、正確理解平衡移動的本質是因正反應速率和逆反應改變的程度不同.


科目:高中化學 來源: 題型:選擇題
| A. | 氫氧化鋇溶液與硫酸的反應OH-+H+=H2O | |
| B. | 鋁粉投入到NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 銅片插入硝酸銀溶液中 Cu+Ag+=Cu2++Ag | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/℃ | 25 | t1 | t2 |
| 水的離子積常數 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 開發太陽能、水能、風能等新能源,減少使用煤、石油等化石燃料 | |
| B. | 研究采煤、采油新技術,提高產量以滿足工業生產的快速發展 | |
| C. | 在農村推廣使用沼氣 | |
| D. | 減少資源消耗、增加資源的重復使用和資源的循環再生 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
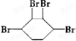
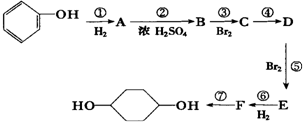 已知實驗室由
已知實驗室由 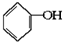 合成
合成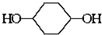 的反應流程如下 (部分試劑和反應條件已略去) (X代表鹵素原子,R代表烴基)
的反應流程如下 (部分試劑和反應條件已略去) (X代表鹵素原子,R代表烴基) 、D
、D
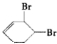 、
、
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2分子的結構式:O=C=O | |
| B. | S2-的結構示意圖: | |
| C. | R2+離子核外有a個電子,b個中子,R原子符號為:${\;}_{a+2}^{a+b+2}$R | |
| D. | 次氯酸的電子式: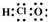 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 漂白粉的成分為次氯酸鈣,是純凈物 | |
| B. | 實驗室可用濃硫酸干燥氨氣 | |
| C. | 實驗室可用NaOH溶液處理SO2和HCl廢氣 | |
| D. | 干燥Cl2可使干燥有色布條褪色 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com