
有一透明溶液,已知其中可能含有的離子為:Mg2+、Cu2+、Fe2+、Al3+、NH4+、K+、Cl-、HCO3-、SO42-。當加入一種淡黃色粉末狀固體物質時,有刺激性氣味的混合氣體放出,同時生成白色沉淀。當加入0.4mol淡黃色粉末時,共收集到0.3mol混合氣體,且此時生成的沉淀最多。此后繼續加入淡黃色粉末時,沉淀量逐漸減少,至加入0.45mol粉末后,沉淀量由0.3mol減少至0.2mol,再加入粉末后,沉淀就不再減少。由此實驗現象及數據判斷:
(1)淡黃色粉末的名稱為 ;
(2)溶液中肯定有 離子,肯定沒有 離子,可能有__________離子;
(3)寫出下列反應方程式:
①淡黃粉末與水反應 ;
②產生刺激性氣味氣體的離子方程式 ;
③加入淡黃色粉末的物質的量由0.4mol至0.45mol時,沉淀部分消失,反應的離子方程式為 ;
(4)溶液中陽離子的物質量之比為 (H+及沒有確定的離子除外)
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源:2016-2017學年陜西省高二上期中化學卷(解析版) 題型:填空題
某種工業廢水中含有一定量的Cr2O72-和CrO42-,它們易被人體吸收積累而導致肝癌。污水處理廠常用還原沉淀法處理含鉻廢水,其流程如下:
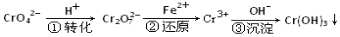
(1)已知第①步存在平衡:2CrO42-(黃色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
① Cr2O72-中Cr的化合價是 。
② 常溫下,若平衡體系的pH=10,則溶液顯 色。
(2)第②步發生反應的離子方程式為 ,還原1 mol Cr2O72-離子,需要 mol的FeSO4·7H2O;
(3)常溫下,Cr(OH)3的溶度積Ksp=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH應調至 。
查看答案和解析>>
科目:高中化學 來源:2017屆陜西省高三上學期第三次質檢化學試卷(解析版) 題型:選擇題
下列各項操作中,不發生“先產生沉淀,然后沉淀又溶解”現象的是
①向石灰水中逐漸通入過量CO2
②向Ca(ClO)2溶液中逐漸通入過量SO2
③向氫氧化鋁膠體中逐滴滴入過量稀NaOH溶液
④向氯化鋇溶液中逐漸通入過量二氧化硫
⑤向AgNO3溶液中逐滴滴入過量稀氨水
⑥向飽和碳酸鈉溶液中逐漸通入過量二氧化碳
A.①②⑥ B.①③⑤ C.②④⑥ D.③④⑤
查看答案和解析>>
科目:高中化學 來源:2017屆山東省日照市高三上學期期中化學試卷(解析版) 題型:選擇題
合成氨及其相關工業中,部分物質間的轉化關系如下:
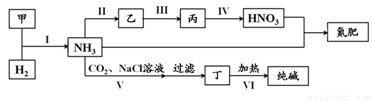
下列說法不正確的是( )
A.反應Ⅱ、III和Ⅳ的氧化劑一定相同
B.甲、乙、丙三種物質中都含有氮元素
C.反應Ⅵ的部分產物可在上述流程中循環利用
D. 反應V的化學方程式為NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
反應V的化學方程式為NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
查看答案和解析>>
科目:高中化學 來源:2017屆山東省日照市高三上學期期中化學試卷(解析版) 題型:選擇題
化學 與生活息息相關。下列說法正確的是( )
與生活息息相關。下列說法正確的是( )
A.A12O3作耐火材料是因為氧化鋁熔點高
B.醫療上,碳酸氫鈉是治療胃穿孔的一種藥劑
C.鐵在潮濕的空氣中放置,易發生化學腐蝕而生銹
D.石英、水晶、水泥、光導纖維等物質的主要成分是SiO2
查看答案和解析>>
科目:高中化學 來源:2017屆寧夏高三上學期第三次月考化學試卷(解析版) 題型:選擇題
中學常見物質A、B、C、D、E、X,存在下圖轉化關系 (部分生成物和反應條件略去)。下列推斷不正確的是( )
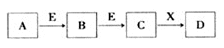
A.若D是一種白色沉淀,在空氣中最終變為紅褐色,則A可能是鐵
B.若D是一種強堿,則A、B、C均可與X反應生成D
C.若D為NaCl,且A可與C反應生成B,則E可能是CO2
D.若D是一種強酸,則A既可以是單質,也可以是化合物,且D可與銅反應生成B或 C
查看答案和解析>>
科目:高中化學 來源:2017屆河南省高三上第三次周考化學卷(解析版) 題型:實驗題
甲同學進行Fe2+還原性的實驗,針對異常現象進行探究。
步驟一:制取FeCl2溶液.向0.1mol·L-1 FeCl3溶液中加足量鐵粉振蕩,靜置后取上層清液,測得pH<1。
實驗二:向2mL FeCl2溶液中滴加2滴0.1mol·L-1KSCN溶液,無現象;再滴加5滴5% H2O2溶液(物質的量濃度約為1.5mol·L-1、pH約為5),觀察到溶液變紅,大約10秒左右紅色褪去,有氣體生成(經檢驗為O2).
(1)用離子方程式表示步驟二中溶液變紅的原因:________________。
(2)甲探究步驟二中溶液褪色的原因:
Ⅰ.取褪色后溶液兩份,一份滴加FeCl3溶液無現象;另一份滴加KSCN溶液出現紅色;
Ⅱ.取褪色后溶液,滴加鹽酸和BaCl2溶液,產生白色沉淀。
Ⅲ.向2mL 0.1mol·L-1 FeCl3溶液中滴加2滴0.1mol·L-1KSCN溶液,變紅,通入O2,無明顯變化。
①實驗I的說明__________________;
②實驗Ⅲ的目的是____________________。
得出結論:溶液褪色的原因是酸性條件下H2O2將SCN-氧化成SO42-。
(3)①甲直接用FeCl2·4H2O配制_________mol·L-1的FeCl2溶液,重復步驟二中的操作,發現液體紅色并未褪去,進一步探究其原因:
②.用激光筆分別照射紅色液體和滴加了KSCN溶液的FeCl3溶液,前者有丁達爾效應,后者無.測所配FeCl2溶液的pH約為3.由此,乙認為紅色不褪去的可能原因是:____________________。
③.查閱資料后推測,紅色不褪去的原因還可能是pH較大時H2O2不能氧化SCN-.乙利用上述部分試劑,通過實驗排除了這一可能.乙的實驗操作及現象是:
步驟 | 試劑及操作 | 現 象 |
i | 生成白色沉淀 | |
ii | 向i所得溶液中滴加0.1mol·L-1 FeCl3溶液 |
查看答案和解析>>
科目:高中化學 來源:2017屆河北省高三上11月月考化學卷(解析版) 題型:選擇題
用NA表示阿伏加德羅常數,下列說法中正確的是
A.常溫常壓下22.4L的CO2在一定條件下與足量的鎂反應,轉移4NA個電子
B.60g SiO2中含硅氧鍵數目為4NA
C.1.00mol NaCl中含有6.02×1023個NaCl分子
D.3.9gNa2O2中所含的陰離子數目為0.1NA
查看答案和解析>>
科目:高中化學 來源:2017屆甘肅省高三上12月月考化學試卷(解析版) 題型:選擇題
某小組同學用如圖所示裝置研究電化學原理。下列關于該原電池的說法不正確的是

A.原電池的總反應為Fe+Cu2+═Fe2++Cu
B.鹽橋中是KNO3溶液,則鹽橋中NO3﹣移 向乙燒杯
向乙燒杯
C.其他條件不變,若將CuCl2溶液換為NH4Cl溶液,石墨電極反應式為2H++2e﹣═H2↑
D.反應前,電極質量相等,一段時間后,兩電極質量相差12g,導線中通過0.2mol電子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com