
【題目】研究和深度開發(fā)CO、CO2的應用對構建生態(tài)文明社會具有重要的意義。
(1)CO可用于煉鐵,
已知:Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
則CO還原Fe2O3(s)的熱化學方程式為___________________________________。
(2)分離高爐煤氣得到的CO與空氣可設計成燃料電池(以KOH溶液為電解液)。寫出該電池的負極反應式:____________________。
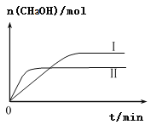
(3)CO2和H2充入一定體積的密閉容器中,在兩種溫度下發(fā)生反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),測得CH3OH的物質的量隨時間的變化如圖。①曲線I、Ⅱ對應的平衡常數大小關系為KⅠ_____KⅡ(填“>”或“=”或“<”)。
CH3OH(g)+H2O(g),測得CH3OH的物質的量隨時間的變化如圖。①曲線I、Ⅱ對應的平衡常數大小關系為KⅠ_____KⅡ(填“>”或“=”或“<”)。
②一定溫度下,在容積相同且固定的兩個密閉容器中,按如下方式加入反應物,一段時間后達到平衡。
容 器 | 甲 | 乙 |
反應物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后氣體的壓強為開始的0.8倍,要使平衡后乙與甲中相同組分的體積分數相等,且起始時維持化學反應向逆反應方向進行,則c的取值范圍為________。
③一定溫度下,此反應在恒壓容器中進行,能判斷該反應達到化學平衡狀態(tài)的依據是_____。
a.容器中壓強不變 b.H2的體積分數不變 c.c(H2)=3c(CH3OH)
d.容器中密度不變 e.2個C=O斷裂的同時有3個H-H斷裂
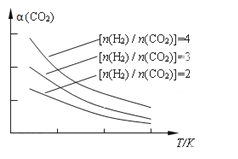
(4)將燃煤廢氣中的CO2轉化為二甲醚的反應原理為:2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(g)。已知一定條件下,該反應中CO2的平衡轉化率隨溫度、投料比[n(H2) / n(CO2)]的變化曲線如下圖。若溫度升高,則反應的平衡常數K將____(填“增大”、“減小”或“不變”。下同);若溫度不變,提高投料比n(H2)/n(CO2),則K將__________;該反應△H_________0(填“>”、“<”或“=”)。
CH3OCH3(g) + 3H2O(g)。已知一定條件下,該反應中CO2的平衡轉化率隨溫度、投料比[n(H2) / n(CO2)]的變化曲線如下圖。若溫度升高,則反應的平衡常數K將____(填“增大”、“減小”或“不變”。下同);若溫度不變,提高投料比n(H2)/n(CO2),則K將__________;該反應△H_________0(填“>”、“<”或“=”)。
【答案】Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);ΔH=-28.5 kJ·mol-1 CO-2e-+4OH-=CO32-+2H2O > 1≥c>0.4 bd 減小 不變 <
【解析】
(1)根據蓋斯定律對已知的兩個熱化學方程式進行加合運算;
(2)分析CO燃燒反應方程式2CO+O2=2CO2,分析元素化合價變化確定負極原料及電子轉移數目,電解質顯強堿性,CO2、H+不能大量存在;
(3) ①一定溫度下,可逆反應達到平衡狀態(tài)時生成物濃度冪之積與反應物濃度冪之積的比值是一個常數,稱之為化學平衡常數,本題圖像是生成物CH3OH的物質的量與時間函數關系,“先拐先平”的原則,生成物濃度越大,則反應物濃度越小,平衡常數就越大。②因為“要使平衡后乙與甲中相同組分的體積分數相等”,所以甲、乙互為“等同平衡”,平衡時各組分物質的量分別對應相等,利用“三段式”確定甲、乙容器中平衡時CH3OH物質的量,若使起始時維持化學反應向逆反應方向進行,則CH3OH初始物質的量不能低于平衡時的CH3OH物質的量,另外,只有反應完全從生成物開始,c才能取最大值。③判斷化學平衡狀態(tài)的標志有兩條依據:一是根據正、逆反應速率相等;二是某一物理量不變時,“變量不變”。
(4) 根據平衡常數表達式![]() 分析反應物濃度與生成物濃度的相對變化即可解答。由圖像分析溫度影響平衡移動的方向,再根據勒夏特列原理分析該反應熱△H的正負。
分析反應物濃度與生成物濃度的相對變化即可解答。由圖像分析溫度影響平衡移動的方向,再根據勒夏特列原理分析該反應熱△H的正負。
(1)將已知的兩個熱化學方程式編號:①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g); ΔH1=+489.0 kJ·mol-1,②C(s)+CO2(g)=2CO(g);ΔH2=+172.5kJ·mol-1。將①②×3得Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);ΔH=ΔH13ΔH2=489.0 kJ·mol-13×172.5 kJ·mol-1=-28.5 kJ·mol-1。所以CO還原Fe2O3(s)的熱化學方程式為Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);ΔH=-28.5 kJ·mol-1。
(2)該燃料電池總反應為2CO+O2=2CO2,CO在反應中失去電子,所以通入CO的一極是負極,因為電解質溶液是KOH,所以CO2轉化成CO32-,根據碳元素化合價由+2升高到+4,1molCO失去2mol電子,負極反應式為:CO-2e-+4OH-=CO32-+2H2O
(3)①圖像I、II曲線平行于時間軸對應的狀態(tài)是平衡狀態(tài),平衡狀態(tài)時CH3OH物質的量曲線I比曲線II多,因容器體積一定,所以平衡時曲線I的生成物濃度比曲線II的生成物濃度高,根據平衡常數表達式![]() ,可知曲線I的平衡常數比曲線II要大,所以KⅠ>KⅡ。
,可知曲線I的平衡常數比曲線II要大,所以KⅠ>KⅡ。
②利用“三段式”先求出甲容器平衡時各組分物質的量。設甲容器平衡時CH3OH的物質的量為x。
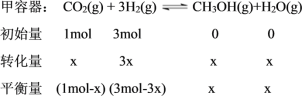
恒溫恒容下,![]() ,則有
,則有![]() ,解得x=0.4mol。甲容器平衡時各組分物質的量分別為CO2為0.6mol、H2為1.8mol、CH3OH為0.4mol、H2O(g)為0.4mol。
,解得x=0.4mol。甲容器平衡時各組分物質的量分別為CO2為0.6mol、H2為1.8mol、CH3OH為0.4mol、H2O(g)為0.4mol。
因為“要使平衡后乙與甲中相同組分的體積分數相等”,甲、乙互為“等同平衡”,所以達到平衡時甲、乙容器中各組分物質的量分別對應相等。要使反應開始時逆向進行則有下列相關量:
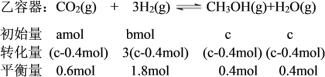
若使起始時維持化學反應向逆反應方向進行,初始投入的CH3OH和H2O(g)的物質的量不能低于它們平衡時的物質的量,即c>0.4,
初始時全部由生成物投料c取最大值,即a、b為0, (c-0.4mol)=0.6mol,解得c=1,所以c的范圍是1≥c>0.4。
③a.因為反應在恒壓條件下進行,容器中壓強一直未變化,所以容器中壓強不變不能作為反應達到平衡狀態(tài)的依據,a項錯誤;
b.反應過程中H2的體積分數一直在變化,所以H2的體積分數不變能判斷該反應已達平衡狀態(tài),b項正確;
c. c(H2)=3c(CH3OH),但反應過程中其數值可能在變也可能不變,所以c(H2)=3c(CH3OH)不能判斷該反應已達平衡狀態(tài),c項錯誤;
d.根據質量守恒可知反應混合物總質量[m(總)]不變,但反應過程中氣體的體積(V)一直在變化,根據密度![]() 可知容器中氣體密度一直在變化,所以容器中氣體密度不變可判斷該反應達到平衡狀態(tài),d項正確;
可知容器中氣體密度一直在變化,所以容器中氣體密度不變可判斷該反應達到平衡狀態(tài),d項正確;
e.CO2結構是O=C=O,H2的結構是H—H,單位時間內“2個C=O斷裂”是用CO2表示的正反應速率,單位時間內“3個H—H斷裂”是用H2表示的正反應速率,無法確定正、逆反應速率是否相等,所以2個C=O斷裂的同時有3個H-H斷裂不能判斷該反應達到平衡狀態(tài),e項錯誤;答案選bd。
(4)由圖像知在投料比不變時CO2的平衡轉化率隨溫度的升高而減小,即生成物濃度越來越小,反應物濃度越來越大,根據平衡常數表達式![]() 推知平衡常數值越來越小,所以升高溫度,反應的平衡常數K將減小。因為平衡常數只受溫度的影響,與濃度無關,所以溫度不變時,提高投料比,平衡常數K不變。由圖像知隨溫度升高CO2的平衡轉化率減小,即平衡向逆反應方向移動,根據勒夏特列原理,逆反應方向是吸熱反應,則正反應為放熱反應,即該反應△H<0。
推知平衡常數值越來越小,所以升高溫度,反應的平衡常數K將減小。因為平衡常數只受溫度的影響,與濃度無關,所以溫度不變時,提高投料比,平衡常數K不變。由圖像知隨溫度升高CO2的平衡轉化率減小,即平衡向逆反應方向移動,根據勒夏特列原理,逆反應方向是吸熱反應,則正反應為放熱反應,即該反應△H<0。


科目:高中化學 來源: 題型:
【題目】某化學興趣小組的同學用如圖所示裝置研究電化學問題。當閉合該裝置的電鍵時,觀察到電流計的指針發(fā)生偏轉。下列有關說法正確的是( )
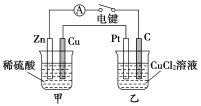
A. 甲裝置是電解池,乙裝置是原電池
B. 當甲中產生0.1 mol氣體時,乙中析出固體的質量為6.4 g
C. 實驗一段時間后,甲燒杯中溶液的pH減小
D. 將乙中的C電極換成銅電極,則乙裝置可變成電鍍裝置
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】球墨鑄鐵中含有一種鐵碳化合物X。實驗室測定化合物X的組成實驗如下:
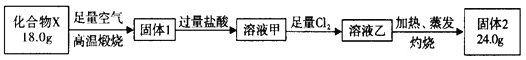
下列說法不正確的是
A. 固體2是氧化鐵 B. X的化學式可以表示為Fe3C2
C. 溶液甲中可能含有Fe3+ D. X與足量的熱濃硝酸反應有NO2和CO2生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業(yè)上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO)。一化學小組在室溫下將氯氣緩緩通入NaOH溶液,模擬實驗得到ClO-、ClO3-等離子的物質的量(mol)與反應時間t(min)的關系曲線。下列說法不正確的是
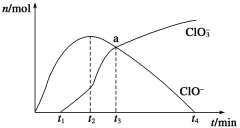
A. 工業(yè)制取漂白液的化學反應方程式為Cl2+2NaOH=NaCl+NaClO+H2O
B. a點時溶液中各離子濃度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)>c(OH-)>c(H+)
C. t2~t4,ClO-離子的物質的量下降的原因可能是3ClO-= 2Cl-+ClO3-
D. 使用漂白液時,為了增強漂白效果,可以向漂白液中加入濃鹽酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D四種化合物,有的是藥物,有的是香料。它們的結構簡式如下所示:
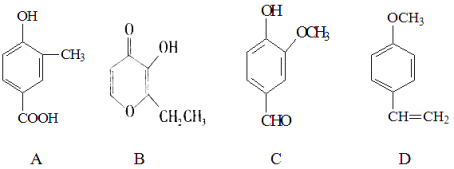
(1)化合物A的分子式是 ;A中含有的官能團的名稱是 、
(2)A、B、C、D四種化合物中互為同分異構體的是(填序號) ;
(3)化合物B的核磁共振氫譜中出現(xiàn) 組峰;
(4)1mol D最多能與 mol的氫氣發(fā)生加成反應;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,將一元酸HA溶液和KOH溶液等體積混合,實驗數據如下表:
實驗編號 | 起始濃度/(mol·L-1) | 反應后溶 液的pH | |
[HA] | [KOH] | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判斷不正確的是( )
A. 實驗①反應后的溶液中:[K+]>[A-]>[OH-]>[H+]
B. 實驗①反應后的溶液中:[OH-]=[K+]-[A-]=![]() mol·L-1
mol·L-1
C. 實驗②反應后的溶液中:[A-]+[HA]>0.1 mol·L-1
D. 實驗②反應后的溶液中:[K+]=[A-]>[OH-]=[H+]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關苯、乙酸、乙醇說法正確的是
A. 都不易溶于水
B. 除乙酸外,其余都不能與金屬鈉反應
C. 苯能與溴水在鐵作催化劑下發(fā)生取代反應
D. 乙醇與乙酸都能發(fā)生取代反應
查看答案和解析>>
科目:高中化學 來源: 題型:
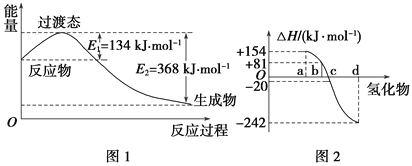
【題目】試回答下列各題:
(1)如圖1所示是NO2和CO反應生成CO2和NO過程中能量變化示意圖,請寫出NO2和CO反應的熱化學方程式: ______________________________。
(2)化學反應的焓變與反應物和生成物的鍵能有關。
①已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol-1
請?zhí)羁眨?/span>
共價鍵 | H—H | Cl—Cl | H—Cl |
鍵能/(kJ·mol-1) | 436 | 247 | ________ |
②圖2中表示氧族元素中氧、硫、硒、碲生成氫化物時的焓變數據,根據焓變數據可確定a、b、c、d分別代表哪種元素,試寫出硒化氫在熱力學標準狀態(tài)下,發(fā)生分解反應的熱化學方程式: ___________________________________。
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com