
【題目】二甲醚是一種重要的清潔燃料,可替代氟利昂作制冷劑,對臭氧層無破壞作用。工業(yè)上可利用煤的氣化產(chǎn)物(水煤氣)合成二甲醚。請回答下列問題:
(1)利用水煤氣合成二甲醚的總反應(yīng)為:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g);ΔH=-246.4 kJ·mol-1 它可以分為兩步,反應(yīng)分別如下:
CH3OCH3(g)+CO2(g);ΔH=-246.4 kJ·mol-1 它可以分為兩步,反應(yīng)分別如下:
①4H2(g)+2CO(g)===CH3OCH3(g)+H2O(g), ΔH1=-205.1 kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g);ΔH2=________。
(2)在一定條件下的密閉容器中,該總反應(yīng)達(dá)到平衡,只改變一個條件能同時提高反應(yīng)速率和CO轉(zhuǎn)化率的是________(填字母代號)。
A.降低溫度 B.加入催化劑
C.縮小容器體積 D.增加H2的濃度
E.增加CO的濃度
(3)在一體積可變的密閉容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,在一定溫度和壓強下發(fā)生反應(yīng):3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),經(jīng)一定時間達(dá)到平衡,并測得平衡時混合氣體密度是同溫同壓下起始時的1.6倍。
CH3OCH3(g)+CO2(g),經(jīng)一定時間達(dá)到平衡,并測得平衡時混合氣體密度是同溫同壓下起始時的1.6倍。
問:①反應(yīng)開始時正、逆反應(yīng)速率的大小:v(正)______(填“>”、“<”或“=”)v(逆)。
②平衡時n(CH3OCH3)=________,平衡時CO的轉(zhuǎn)化率=________。
【答案】-41.3KJ/mol CD > 1.75 75%
【解析】
根據(jù)題意可知,本題考查焓變的計算、轉(zhuǎn)化率大小和計算及反應(yīng)速率的大小比較,運用蓋斯定律,勒夏特列原理分析。
(1)③3H2(g)+3CO(g)CH3OCH3(g)+CO2(g)ΔH=-246.4 kJ·mol-1;①4H2(g)+2CO(g)===CH3OCH3(g)+H2O(g)ΔH1=-205.1 kJ·mol-1;②CO(g)+H2O(g)===CO2(g)+H2(g)ΔH2;由蓋斯定律:①+②=③可得:ΔH=ΔH1+ΔH2=-205.1kJ·mol-1+ΔH2=-246.4 kJ·mol-1,解得ΔH2=-41.3 kJ·mol-1;
故答案為:-41.3 kJ·mol-1;
(2)A.正反應(yīng)為放熱反應(yīng),降低溫度,平衡向正反應(yīng)方向移動,CO的轉(zhuǎn)化率增大,但反應(yīng)速率減小,故A錯誤;
B.加入催化劑,反應(yīng)速率增大,不影響平衡移動,CO的轉(zhuǎn)化率不變,故B錯誤;
C.正反應(yīng)為氣體體積減小的反應(yīng),縮小容器體積,壓強增大,反應(yīng)速率增大,平衡向正反應(yīng)方向移動,CO的轉(zhuǎn)化率增大,故C正確;
D.增加H2的濃度,反應(yīng)速率增大,平衡向正反應(yīng)移動,CO的轉(zhuǎn)化率增大,故D正確;
E.增加CO的濃度,反應(yīng)速率增大,平衡向正反應(yīng)移動,但CO的轉(zhuǎn)化率減小,故E錯誤;
故答案為:CD;
(3)①同溫同壓下,氣體密度之比等于平均相對分子質(zhì)量之比,平衡時混合氣體密度增大,說明混合氣體物質(zhì)的量減小,反應(yīng)正向進(jìn)行建立平衡,故v(正)>v(逆);
故答案為:>;
②平衡時混合氣體密度是同溫同壓下起始時的1.6倍,則平衡時混合氣體物質(zhì)的量為(3mol+3mol+1mol+1mol)×![]() =5mol,則:
=5mol,則:
故平衡時n(CH3OCH3)=1.75mol,平衡時CO的轉(zhuǎn)化率為為![]() ;
;
故答案為:1.75mol;75%。


科目:高中化學(xué) 來源: 題型:
【題目】電動汽車常用電池為鈷酸鋰電池,工作時原理如圖,N極材料是金屬鋰和碳的復(fù)合材料,電解質(zhì)為一種能傳導(dǎo)Li+的固體電解質(zhì),電池反應(yīng)式:
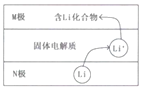
LixC6+Li1-xCoO2![]() C6+LiCoO2.下列說法錯誤的是( )
C6+LiCoO2.下列說法錯誤的是( )
A.放電時電子從N極流向M極
B.放電時N電極的反應(yīng)式為:LixC6-xe-=xLi++C6
C.M極的物質(zhì)具有較強還原性
D.相對于傳統(tǒng)鉛蓄電池,鋰電池的比能量較高
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】甲、乙兩個實驗小組利用![]() 酸性溶液與
酸性溶液與![]() 溶液反應(yīng)研究影響反應(yīng)速率的因素。
溶液反應(yīng)研究影響反應(yīng)速率的因素。
設(shè)計實驗方案如下![]() 實驗中所用
實驗中所用![]() 溶液均已加入
溶液均已加入![]() :
:
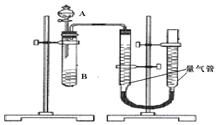
甲組:通過測定單位時間內(nèi)生成![]() 氣體體積的大小來比較化學(xué)反應(yīng)速率的大小某同學(xué)進(jìn)行實驗,實驗裝置如圖.其中A、B的成分見表
氣體體積的大小來比較化學(xué)反應(yīng)速率的大小某同學(xué)進(jìn)行實驗,實驗裝置如圖.其中A、B的成分見表
序號 | A溶液 | B溶液 |
① |
|
|
② |
|
|
③ |
|
|
![]() 該反應(yīng)的離子方程式為 ______
該反應(yīng)的離子方程式為 ______
![]() 實驗開始前需要檢查氣密性.分液漏斗中A溶液應(yīng)該 ______ 加入
實驗開始前需要檢查氣密性.分液漏斗中A溶液應(yīng)該 ______ 加入![]() 填“一次性”或“逐滴滴加”
填“一次性”或“逐滴滴加”![]()
![]() 完成該實驗還需要 ______
完成該實驗還需要 ______ ![]() 填儀器名稱
填儀器名稱![]() ,實驗結(jié)束后讀數(shù)前需要移動量氣管,使兩個量氣管的液面相平.
,實驗結(jié)束后讀數(shù)前需要移動量氣管,使兩個量氣管的液面相平.
乙組:通過測定![]() 溶液褪色所需時間的多少來比較化學(xué)反應(yīng)速率為了探究
溶液褪色所需時間的多少來比較化學(xué)反應(yīng)速率為了探究![]() 與
與![]() 濃度對反應(yīng)速率的影響,某同學(xué)在室溫下完成以下實驗
濃度對反應(yīng)速率的影響,某同學(xué)在室溫下完成以下實驗
實驗編號 | 1 | 2 | 3 | 4 |
水 | 10 | 5 | 0 | X |
| 5 | 10 | 10 | 5 |
| 5 | 5 | 10 | 10 |
時間 | 40 | 20 | 10 | --- |
![]() ______ ,4號實驗中始終沒有觀察到溶液褪色,你認(rèn)為可能的原因是 ______ 。
______ ,4號實驗中始終沒有觀察到溶液褪色,你認(rèn)為可能的原因是 ______ 。
![]() 號反應(yīng)中,
號反應(yīng)中,![]() 的反應(yīng)速率為 ______。
的反應(yīng)速率為 ______。
![]() 在實驗中發(fā)現(xiàn)高錳酸鉀酸性溶液和草酸溶液反應(yīng)時,開始一段時間反應(yīng)速率較慢,溶液褪色不明顯;但不久突然褪色,反應(yīng)速率明顯加快.某同學(xué)認(rèn)為是放熱導(dǎo)致溶液溫度升高所致,重做3號實驗,測定過程中溶液不同時間的溫度,結(jié)果如表:
在實驗中發(fā)現(xiàn)高錳酸鉀酸性溶液和草酸溶液反應(yīng)時,開始一段時間反應(yīng)速率較慢,溶液褪色不明顯;但不久突然褪色,反應(yīng)速率明顯加快.某同學(xué)認(rèn)為是放熱導(dǎo)致溶液溫度升高所致,重做3號實驗,測定過程中溶液不同時間的溫度,結(jié)果如表:
時間 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
溫度℃ | 25 | 26 | 26 | 26 |
| 27 | 27 |
結(jié)合實驗?zāi)康呐c表中數(shù)據(jù),你得出的結(jié)論是 ______。
![]() 從影響化學(xué)反應(yīng)速率的因素看,你的猜想還可能是 ______ 的影響。若用實驗證明你的猜想,除了酸性高錳酸鉀溶液和草酸溶液外,還需要選擇的試劑最合理的是 ______
從影響化學(xué)反應(yīng)速率的因素看,你的猜想還可能是 ______ 的影響。若用實驗證明你的猜想,除了酸性高錳酸鉀溶液和草酸溶液外,還需要選擇的試劑最合理的是 ______ ![]() 填字母
填字母![]() 。
。
A 硫酸鉀![]() 水
水![]() 二氧化錳
二氧化錳![]() 硫酸錳。
硫酸錳。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】化合物M(結(jié)構(gòu)式如下圖)是最常用的還原劑,由H·C· Brown和 Schlesinger于1942年在芝加哥大學(xué)發(fā)現(xiàn),其中X、Y、Z是原子序數(shù)依次減小的不同短周期主族元素,X與W、Z與W均能形成原子個數(shù)比為1:1和2:1的化合物,W原子的最外層電子數(shù)是電子層數(shù)的3倍,下列敘述正確的是( )
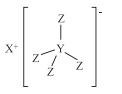
A.Y的最高價氧化物對應(yīng)的水化物是一種一元弱酸
B.Z元素位于第3周期第ⅦA族
C.X和Z形成的化合物的水溶液呈酸性
D.化合物M不能與Z2W2反應(yīng)
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】已知NA是阿伏加德羅常數(shù)的值,下列說法正確的是( )
A.標(biāo)準(zhǔn)狀況下,7.8g乙炔和苯的混合物中含C—H鍵數(shù)目為0.6NA
B.10g46%的乙醇溶液中,含H—O鍵的數(shù)目為0.1NA
C.1L0.1mol·L1 FeCl3溶液中含Fe3+數(shù)目為0.1NA
D.將1molNH3通入足量水中,NH3 ·H2O、NH4+ 粒子數(shù)目之和為NA
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】按要求填空
(1)寫出下列物質(zhì)在水中電離方程式:
NaHSO4_____________________________NH3·H2O______________________________________________________
(2)寫出下列物質(zhì)水解的離子方程式:
NaHCO3___________________________ FeCl3_____________________________
(3)常溫時,0.1mol/L的NaOH和0.06mol/L 的H2SO4溶液等體積混合,求混合溶液的pH為_______。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】25° C時,0.100 mol· L-1鹽酸滴定25. 00 mL0. 1000 mol . L-1'氨水的滴定曲線如圖所示。下列說法正確的是

A.滴定時,可迄用甲基橙或酚酞為指示劑
B.a、b兩點水電離出的OH-濃度之比為10-4. 12
C.c點溶液中離子濃度大小順序為c(Cl-) >c(NH4+)>c(H+ ) >c(OH-)
D.中和等體積等pH的氨水和NaOH溶液時消耗相同濃度鹽酸的體積相等
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】設(shè)NA為阿伏加德羅常數(shù)的值。下列說法正確的是
A.標(biāo)準(zhǔn)狀況下,4.48L 空氣中所含原子數(shù)為0.2NA
B.常溫常壓下,2.3g NO2和N2O4的混合物中含有的氧原子數(shù)為0.2NA
C.過氧化鈉與水反應(yīng)時,生成0.1mol氧氣轉(zhuǎn)移的電子數(shù)為0.2 NA
D.常溫下,0.1 mol·L-1Na2CO3溶液中陰離子總數(shù)大于0.1 NA
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】新型鋰一空氣電池具有能量密度高的優(yōu)點,有望成為新能源汽車的電源,其結(jié)構(gòu)如圖所示,其中固體電解質(zhì)只允許![]() 通過。
通過。
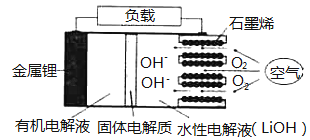
下列說法正確的是 ( )
A.放電時,負(fù)極反應(yīng)式:![]()
B.放電時,當(dāng)外電路中有![]() 轉(zhuǎn)移時,水性電解液離子總數(shù)增加
轉(zhuǎn)移時,水性電解液離子總數(shù)增加![]()
C.應(yīng)用該電池電鍍銅,陰極質(zhì)量增加64g,理淪上將消耗![]()
D.若把水性電解液換成固體氧化物電解質(zhì),則易引起正極材料碳孔堵塞
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com