
| A. | 二氧化碳 | B. | 懸浮顆粒 | C. | 二氧化硫 | D. | 二氧化氮 |
科目:高中化學 來源: 題型:解答題
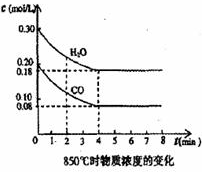 在一體積為 10L的密閉容器中,通入一定量的CO和H2O,在850℃發生如下反應:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.CO和H2O濃度變化如圖:
在一體積為 10L的密閉容器中,通入一定量的CO和H2O,在850℃發生如下反應:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.CO和H2O濃度變化如圖:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
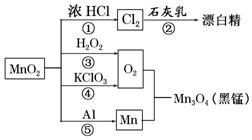
| A. | 只有反應①②④屬于氧化還原反應 | |
| B. | 反應⑤說明該條件下鋁可用于制熔點較高的金屬 | |
| C. | 相同條件下生成等量的O2,反應③和④轉移的電子數之比為1:1 | |
| D. | 反應①中氧化劑與還原劑的物質的量之比為1:4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水陸兩用公共汽車中,用于密封的橡膠材料是高分子化合物 | |
| B. | 下雪后,常用播撒NaCl顆粒方法來防止道路結冰 | |
| C. | 用活性炭為糖漿脫色和用SO2漂白紙漿的原理不同 | |
| D. | 在醫學上用BaSO4做鋇餐,是因為Ba2+對人體無毒 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com