
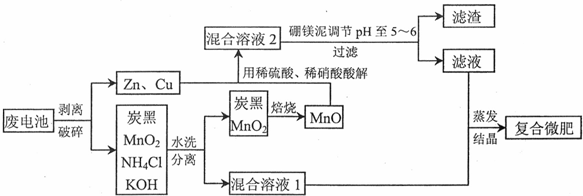
分析 廢電池剝離破碎分離為鋅、銅金屬和炭黑、MnO2、NH4Cl、KOH,其中炭黑、MnO2、NH4Cl、KOH水洗過濾得到濾渣炭黑、MnO2,濾液混合溶液Ⅰ為NH4Cl、KOH水溶液反應后得到一水合氨和氯化鉀,Zn、Cu、MnO被稀硫酸和稀硝酸溶解得到混合溶液Ⅱ,Mn02不溶于硫酸和硝酸,MnO可溶于酸,所以溶液中含有Zn2+、Cu2+、Mn2+,加入硼鎂泥中含MgO,Na2B407,MnO,Fe203,Si02,CaO等化合物來調節溶液PH=5-6,有H3B03沉淀生成,過濾得到濾液和混合溶液Ⅰ混合,通過蒸發濃縮,冷卻結晶,過濾洗滌得到復合微肥;
(1)復合微肥的成分為濾液混合溶液Ⅰ為NH4Cl、KOH水溶液反應后得到一水合氨和氯化鉀,和濾液混合含有農作物生長必需的多種微量元素外,還含有必需的大量元素氮和鉀元素;
(2)焙燒時反應為二氧化錳和碳發生氧化還原反應,生成MnO可溶于酸;
(3)酸解過程中是鋅、銅在稀硝酸溶液中被氧化,稀硝酸被還原為NO,一氧化氮和空氣混合溶于水可以重新生成稀硝酸,酸解后的溶液加入硼鎂泥調節溶液pH時,有H3B03沉淀生成,是Na2B407和酸反應生成;PH=6,c(OH-)=10-8mol/L,依據溶度積常數計算沉淀所需要的錳離子濃度分析判斷,氫氧化鎂和氫氧化錳陰離子和陽離子組成比相同,可以利用溶度積常數大小比較溶解度大小;
(4)依據錳元素守恒,結合離子方程式定量關系計算得到;
(5)選用廢玻璃、粉煤灰、煉鋼爐渣和礦石等為原料高溫燒制,將熔融物冷水淬冷成塊,再磨成細粉即得玻璃微肥,減少溶解避免流失.
解答 解:廢電池剝離破碎分離為鋅、銅金屬和炭黑、MnO2、NH4Cl、KOH,其中炭黑、MnO2、NH4Cl、KOH水洗過濾得到濾渣炭黑、MnO2,濾液混合溶液Ⅰ為NH4Cl、KOH水溶液反應后得到一水合氨和氯化鉀,Zn、Cu、MnO被稀硫酸和稀硝酸溶解得到混合溶液Ⅱ,Mn02不溶于硫酸和硝酸,MnO可溶于酸,所以溶液中含有Zn2+、Cu2+、Mn2+,加入硼鎂泥中含MgO,Na2B407,MnO,Fe203,Si02,CaO等化合物來調節溶液PH=5-6,有H3B03沉淀生成,過濾得到濾液和混合溶液Ⅰ混合,通過蒸發濃縮,冷卻結晶,過濾洗滌得到復合微肥;
(1)復合微肥的成分為濾液混合溶液Ⅰ為NH4Cl、KOH水溶液反應后得到一水合氨和氯化鉀,和濾液混合含有農作物生長必需的多種微量元素外,還含有必需的大量元素氮和鉀元素;
故答案為:鉀;
(2)Mn02不溶于硫酸和硝酸,焙燒時反應為二氧化錳和碳發生氧化還原反應,生成MnO可溶于酸,反應的化學方程式為:MnO2+C$\frac{\underline{\;\;△\;\;}}{\;}$MnO+CO↑,焙燒目的是將不溶于酸的MnO2轉化為可溶于酸的MnO,
故答案為:MnO2+C$\frac{\underline{\;\;△\;\;}}{\;}$MnO+CO↑;將不溶于酸的MnO2轉化為可溶于酸的MnO;
(3)酸解過程中是鋅、銅在稀硝酸溶液中被氧化,稀硝酸被還原為NO,一氧化氮和空氣混合溶于水可以重新生成稀硝酸,可循環利用,酸解后的溶液加入硼鎂泥調節溶液pH時,有H3B03沉淀生成,是Na2B407和酸反應生成,反應的離子方程式為:B4O72-+2H++5H2O=4H3BO3↓,PH=6,c(OH-)=10-8mol/L,依據溶度積常數計算沉淀所需要的錳離子濃度,若析出Mn(OH)2沉淀,所需c(Mn2+)的最小值為$\frac{1.9×1{0}^{-13}}{(1×1{0}^{-8})^{2}}$=1900mol/L,c(Mn2+)不可能達到此數值,故不能析出Mn(OH)2沉淀,氫氧化鎂和氫氧化錳陰離子和陽離子組成比相同,可以利用溶度積常數大小比較溶解度大小,由于Ksp(Mn(OH)2)<Ksp(Mg(OH)2),所以Mn(OH)2也不可能析出,
故答案為:NO;B4O72-+2H++5H2O=4H3BO3↓;PH=6,c(OH-)=10-8mol/L,若析出Mn(OH)2沉淀,所需c(Mn2+)的最小值為$\frac{1.9×1{0}^{-13}}{(1×1{0}^{-8})^{2}}$=1900mol/L,c(Mn2+)不可能達到此數值,故不能析出Mn(OH)2沉淀,由于Ksp(Mn(OH)2)<Ksp(Mg(OH)2),所以Mn(OH)2也不可能析出;
(4)依據錳元素守恒,結合離子方程式定量關系計算,發生反應Mn2++ClO-+H2O═MnO2↓+2H++Cl-,n(MnO2)=n(Mn)=$\frac{bg}{87g/mol}$=$\frac{b}{87}$mol,則產品中錳元素的質量分數=$\frac{\frac{b}{87}mol×55g/mol}{ag}$×100%=$\frac{55b}{87a}$×100%,
故答案為:$\frac{55b}{87a}$×100%;
(5)玻璃可微量溶于水,選用廢玻璃、粉煤灰、煉鋼爐渣和礦石等為原料高溫燒制,將熔融物冷水淬冷成塊,再磨成細粉即得玻璃微肥,減少溶解避免流失,玻璃微肥具有的優點是肥分緩釋,肥分時間長或不易被雨水淋失或不污染環境,
故答案為:肥分緩釋,肥分時間長或不易被雨水淋失或不污染環境.
點評 本題考查了物質分離和提純的分析判斷,主要是反應條件,物質性質的理解應用,沉淀溶解平衡,溶度積常數的計算應用,掌握基礎是關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3的穩定性介于Na2CO3•10H2O和NaHCO3之間 | |
| B. | “侯氏制堿法”制得的堿是指NaHCO3 | |
| C. | 可用鹽酸鑒別Na2CO3 和NaHCO3固體 | |
| D. | 純堿有時可代替燒堿使用,比如溶解石英、吸收氯氣等 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鹵素的單質及其化合物在生產、生活中應用廣泛.
鹵素的單質及其化合物在生產、生活中應用廣泛. (如${\;}_{1}^{2}$H).
(如${\;}_{1}^{2}$H).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 所得溶液中c(Ag+)•c(Cl-)>Ksp(AgCl) | |
| B. | 上述實驗說明Cl-與NH4+間有很強的結合力 | |
| C. | 所得溶液中形成了難電離的物質 | |
| D. | 上述過程中NH3•H2O的電離常數增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ②③④ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈹的氧化物對應的水化物可能具有兩性 | |
| B. | 砹是一種有色固體,HAt很不穩定,AgAt是有色難溶于水的固體 | |
| C. | 高溴酸(HBrO4)的酸性比硒酸(H2SeO4)的酸性弱 | |
| D. | 硫酸鍶(SrSO4)是難溶于水和鹽酸的白色固體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯 | B. | 乙炔 | C. | 丙烯 | D. | 丙炔 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②④⑤⑧⑨ | B. | ①③⑥⑦⑨ | C. | ①③⑤⑥⑦ | D. | ①②③⑤⑥⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 重鉻酸鉀又名紅礬鉀,是化學實驗室中的一種重要分析試劑.工業上以鉻酸鉀(K2CrO4)為原料,采用電化學法制備重鉻酸鉀(K2Cr2O7).制備裝置如圖所示(陽離子交換膜只允許陽離子透過). 制備原理:2CrO42-(黃色)+H+?Cr2O72-(橙色)+H2O.下列說法正確的是( )
重鉻酸鉀又名紅礬鉀,是化學實驗室中的一種重要分析試劑.工業上以鉻酸鉀(K2CrO4)為原料,采用電化學法制備重鉻酸鉀(K2Cr2O7).制備裝置如圖所示(陽離子交換膜只允許陽離子透過). 制備原理:2CrO42-(黃色)+H+?Cr2O72-(橙色)+H2O.下列說法正確的是( )| A. | 電解時惰性電極應與直流電源的負極相連 | |
| B. | 通電后陰極室產生的現象為:產生無色氣體,溶液由無色變黃色 | |
| C. | 制備過程中總的離子方程式為:2CrO42-+3H2O=Cr2O72-+2OH-+2H2↑+O2↑ | |
| D. | 若實驗開始時在右室中加入38.8克的K2CrO4,tmin后測得右室中K與Cr的物質的量之比為3:2,此時電路中轉移電子的物質的量為0.1mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com