

| 烴 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |  |  |  |
| 沸點/℃ | -164 | -88.6 | -0.5 | 熔點/℃ | 45 | 96 | 114 |
分析 (1)I.原子的電離能越大,表示越難失去電子,故化合價也較低,一般來說,元素的電離能按照第一、第二…的順序逐漸增加,如果突然增加的比較多,電離的難度增大,這里就是元素的通常的化合價;
II.根據相對分子質量與物質熔沸點的關系以及氫鍵的存在對物質性質的影響判斷;
III.由表中數據可知,從左到右由烷烴機物的相對分子質量逐漸增大,沸點逐漸升高,硝基苯酚中官能團的相對位置不同,熔點不同,結合氫鍵對物質的物理性質的影響解答該題;
(2)COCl2俗稱光氣,分子中C原子采取sp2雜化成鍵,C原子與氯原子之間形成C-Cl單鍵,故C原子與O原子之間形成C=O雙鍵,雙鍵中含有1個σ鍵、1個π鍵,據此分析解答;
(3)I.根據鈦元素在周期表中的原子序數以及其原子結構來確定位置、基態原子的電子排布式;
II.Ti3+的配位數均為6,往待測溶液中滴入AgNO3溶液,均產生白色沉淀,則有氯離子在配合物的外界,兩份沉淀,經洗滌干燥后稱量,發現原綠色晶體的水溶液與AgNO3溶液反應得到的白色沉淀質量為紫色晶體的水溶液反應得到沉淀質量的$\frac{2}{3}$,可知紫色晶體中含3個氯離子,綠色晶體中含2個氯離子.
解答 解:(1)I.短周期某主族元素M的第一、第二電離能之間變化不大,第三電離能劇增,且第一電離能很低,說明該元素原子很難失去第三個電子,最高化合價為+2,應為第IIA族元素,
故答案為:IIA;
II.在ⅣA~ⅦA中的氫化物里,由于N、O、F電負性大,NH3、H2O、HF因在分子間存在多條結合力較大的氫鍵,總強度遠遠大于分子間作用力,故沸點高于同主族其它元素氫化物的沸點,只有ⅣA族元素氫化物不存在反常現象,
故答案為:IVA;b;
III.由表中數據可知,從左到右由烷烴機物的相對分子質量逐漸增大,沸點逐漸升高;
硝基苯酚有三種同分異構體,其中鄰位形成分子內氫鍵,熔點最低,對位形成分子間氫鍵,作用力最強,熔點最高,
故答案為:有機物相對分子質量越大,分子間作用力越強,故沸點越高;當有機物能形成分子內氫鍵時,分子間作用力減弱,熔點變低;當分子間能形成氫鍵時,分子間作用力增強,熔點升高;
(2)COCl2分子的結構式為: ,COCl2分子中C原子與Cl原子以單鍵相結合,與O原子以雙鍵相結合,C=O鍵中含有1個δ鍵,1個π鍵,則COCl2分子內含有3個σ鍵、1個π鍵,所以C原子為sp2雜化,
,COCl2分子中C原子與Cl原子以單鍵相結合,與O原子以雙鍵相結合,C=O鍵中含有1個δ鍵,1個π鍵,則COCl2分子內含有3個σ鍵、1個π鍵,所以C原子為sp2雜化,
故答案為:sp2;c;
(3)I.鈦元素在周期表中的原子序數為22,位于第四周期第IVB族,基態原子的電子排布式為1s22s22p63S23p63d24s2(或[Ar]3d24s2),22Ti元素基態原子的價電子層排布式為3d24s2;
故答案為:3d24s2;
Ⅱ.Ti3+的配位數均為6,往待測溶液中滴入AgNO3溶液,均產生白色沉淀,則有氯離子在配合物的外界,兩份沉淀,經洗滌干燥后稱量,發現原綠色晶體的水溶液與AgNO3溶液反應得到的白色沉淀質量為紫色晶體的水溶液反應得到沉淀質量的$\frac{2}{3}$,可知紫色晶體中含3個氯離子,綠色晶體中含2個氯離子,即綠色晶體的化學式為:[TiCl(H2O)5]Cl2•H2O,
故答案為:[TiCl(H2O)5]Cl2•H2O.
點評 本題配合物成鍵情況及物質結構與性質等知識,題目難度中等,注意掌握配合物成鍵情況、化學鍵類型及原子軌道雜化方式、有機物結構與性質等知識,試題側重考查學生運用所學知識對圖表、圖象分析、理解能力.


 開心試卷期末沖刺100分系列答案
開心試卷期末沖刺100分系列答案 雙基同步導航訓練系列答案
雙基同步導航訓練系列答案 黃岡小狀元同步計算天天練系列答案
黃岡小狀元同步計算天天練系列答案科目:高中化學 來源: 題型:選擇題

| A. | 該反應的熱化學方程式:N2(g)+3H2(g)═2NH3(l)△H=2(a-b-c) kJ•mol-1 | |
| B. | 該反應的熱化學方程式:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g)△H=(a+b) kJ•mol-1 | |
| C. | 其他條件不變,升高溫度,正、逆反應速率均增大,且H2的轉化率增大 | |
| D. | T1>T2,且正反應為吸熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | PCl5固體是分子晶體 | |
| B. | PCl5固體有良好的導電性 | |
| C. | PCl5晶體由[PCl4]+和[PCl6]-構成,其離子數目之比為1:1 | |
| D. | PCl5晶體由[PCl3]2+和[PCl7]2-構成,其離子數目之比為1:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
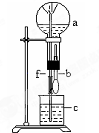
| a(干燥氣體) | b(液體) | |
| A | NO2 | 水 |
| B | CO2 | NaHCO3溶液 |
| C | Cl2 | 飽和NaCl溶液 |
| D | NH3 | 1mol•L-1鹽酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 14g乙烯和丙烯的混合氣體中含有H原子數為2NA | |
| B. | 標準狀況下2.24L乙醇與足量Na反應生成H2分子數0.05NA | |
| C. | 每摩爾-CH3中含10NA個電子 | |
| D. | 每摩爾甲苯中含有的碳碳單鍵的數目為7 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 實驗方案 | 實驗現象 | 有關離子方程式 |
| ①用砂紙擦后的鎂帶與沸水反應,再向反應液中滴加酚酞 | Mg+2H2O(熱水)═Mg(OH)2+H2↑ | |
| ②鈉與滴有酚酞試液的冷水反應 | 2Na+2H2O=2Na++2OH-+H2↑ | |
| ③鎂帶與2mol/L的鹽酸反應 | Mg+2H+═Mg2++H2↑ | |
| ④鋁條與2mol/L的鹽酸反應 | 2Al+6H+=2Al3++3H2↑ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com