
分析 短周期原子序數依次遞增的A、B、C、D、E、F六種元素,B原子最外層電子數是A原子次外層電子數的3倍,是D原子最外層電子數的2倍,則A原子只能有2個電子層,故B元素最外層電子數為6,D原子最外層電子數為3,A的次外層電子數為2;C原子內層電子總數是最外層電子數10倍,則C為Na,B的原子序數小于鈉,則B為O元素;A、B、D三種元素的原子最外層電子數之和為13,則A的最外層為13-6-3=4,所以A的核外電子數為2+4=6,故A為C元素;A和B原子最外層電子數與D和F原子最外層電子數之和相等,則F的最外層為7,F的原子序數最大,故F為Cl元素;D和E是相鄰兩種元素,D原子最外層電子數為3,所以D為Al元素,E為Si元素,據此解答.
解答 解:短周期原子序數依次遞增的A、B、C、D、E、F六種元素,B原子最外層電子數是A原子次外層電子數的3倍,是D原子最外層電子數的2倍,則A原子只能有2個電子層,故B元素最外層電子數為6,D原子最外層電子數為3,A的次外層電子數為2;C原子內層電子總數是最外層電子數10倍,則C為Na,B的原子序數小于鈉,則B為O元素;A、B、D三種元素的原子最外層電子數之和為13,則A的最外層為13-6-3=4,所以A的核外電子數為2+4=6,故A為C元素;A和B原子最外層電子數與D和F原子最外層電子數之和相等,則F的最外層為7,F的原子序數最大,故F為Cl元素;D和E是相鄰兩種元素,D原子最外層電子數為3,所以D為Al元素,E為Si元素.
(1)E為Si元素,基態原子的核外電子排布為1s22s22p63s23p2,占用了8個原子軌道;F元素的名稱:氯,故答案為:8;氯;
(2)非金屬性C>Si,故最高價含氧酸的酸性較強的是H2CO3,故答案為:H2CO3;
(3)由A、B、C三種元素組成原子個數比n(A):n(B):n(C)=1:3:2的化合物為Na2CO3,碳酸鈉中的碳酸根離子會發生水解反應:CO32-+H2O?HCO3-+OH-,所以Na2CO3溶液呈堿性,
故答案為:CO32-+H2O?HCO3-+OH-;
(4)原子的電子層越多,原子半徑越大,電子層相同時,核電荷數越大,原子半徑越小,則原子半徑最大的為Na;
它們的離子核外電子數相同,核電荷數越大,離子半徑越小,則Al3+的半徑最小;
D為Al元素,M元素與D元素位于不同主族,但由于二者的電負性相近,則M為Be元素,BeO與氫氧化鈉反應生成BeO22-和H2O,其離子方程式為:BeO+2OH-=BeO22-+H2O,
故答案為:Na;Al3+;BeO+2OH-=BeO22-+H2O;
(5)E和F形成的化合物X為SiCl4,SiCl4與氫氣制取高純度的單質Si的化學原理是:SiCl4+2H2$\frac{\underline{\;高溫\;}}{\;}$Si+4HCl,
故答案為:SiCl4+2H2$\frac{\underline{\;高溫\;}}{\;}$Si+4HCl.
點評 本題考查位置結構與性質關系的應用,題目難度中等,關鍵是先根據題干信息推斷元素,側重于電子排布和元素周期律知識的綜合應用的考查.


科目:高中化學 來源: 題型:選擇題
| A. | 配制銀氨溶液:向氨水中加入過量的硝酸銀溶液 | |
| B. | 銀鏡反應:向銀氨溶液中滴加葡萄糖溶液后,熱水浴 | |
| C. | 檢驗蔗糖的水解產物:先加堿中和,再滴入新制的氫氧化銅中加熱 | |
| D. | 淀粉水解:向淀粉溶液中加入唾液,加熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將少量Na2O2粉末加入到H218O水中:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| B. | 向AlC13溶液中加入過量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 氯化亞鐵溶液中通入足量C12:Fe2++C12═Fe3++2C1- | |
| D. | 往NH4HSO4溶液中加入足量NaOH溶液:NH4++H++2OH-═NH3•H2O+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
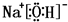 或
或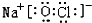 .
.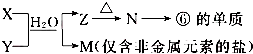
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 基態原子第五電子層只有2個電子,則該原子第四電子層的電子數肯定為8或18個 | |
| B. | 核外電子數為奇數的基態原子,其原子軌道中一定含有未成對電子 | |
| C. | R為第二周期元素,其原子具有的電子層數為最外層電子數的$\frac{1}{2}$,它可能形成的含氧酸根離子有 ①RO${\;}_{3}^{2-}$、②R2O${\;}_{4}^{2-}$、③RO${\;}_{4}^{2-}$ | |
| D. | Li、Be、B三種元素的第一電離能(I1)差別不大,而I2差別很大,則三種原子中最難失去第二個電子的是Be |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 烴 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |  |  |  |
| 沸點/℃ | -164 | -88.6 | -0.5 | 熔點/℃ | 45 | 96 | 114 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

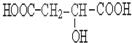 請回答:
請回答: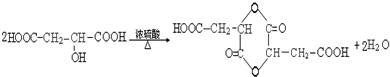 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com