

| 反應 | 大氣固氮 | 工業固氮 | ||||
| 溫度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
| 時間/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
分析 (1)反應物總鍵能-生成物總鍵能=反應熱,據此計算;鍵能越大,化學鍵越強;
(2)A、化學平衡常數說明反應進行的徹底程度問題,與反應進行的難易程度無關;
B、大氣固氮的進行程度很小,利用大氣固氮原理進行工業生成,產率很小;
C、合成氨是放熱反應,溫度越低,有利于平衡向正反應移動,反應的轉化率越高;
D、化學平衡常數說明反應進行的徹底程度問題,與反應速率無關;
(3)①根據表中數據計算四氧化二氮的反應速率,根據速率之比等于化學計量數之比計算二氧化氮的反應速率;
②反應達到60s時達到化學平衡狀態,N2O4的物質的量不再變化,計算出平衡時各物質的物質的量,根據四氧化二氮的體積分數=$\frac{n(N{\;}_{2}O{\;}_{4})}{n(總)}$×100%進行計算;
③恒溫下如向該密閉容器中再充入0.32molHe氣,并把容器體積擴大為4L,則二氧化氮和四氧化二氮的濃度都減小,相當于減小壓強,所以V(正)、V(逆)速率都減小,平衡向逆反應方向移動.
解答 解:(1)N≡N鍵能為x,則3×436kJ/mol+x-2×1173.2kJ/mol=-92.4kJ/mol,解得x=946kJ/mol,故斷裂1mol N≡N鍵需要能量是946kJ,O=O鍵能是498kJ/mol,故氮氣分子中化學鍵比氧氣分子中的化學鍵強,
故答案為:946;強;
(2)A、化學平衡常數說明反應進行的徹底程度問題,與反應進行的難易程度無關,故A錯誤;
B、大氣固氮的進行程度很小,利用大氣固氮原理進行工業生成,產率很小,沒有實際意義,故B正確;
C、合成氨是放熱反應,溫度越低,有利于平衡向正反應移動,反應的轉化率越高,反應越完全,故C正確;
D、化學平衡常數說明反應進行的徹底程度問題,與反應速率無關,故D錯誤;
故答案為:BC;
(3)①由表中數據可知,從反應開始直至20s時,v(N2O4)=$\frac{\frac{0.05mol}{2L}}{20s}$=0.00125mol•L-1•S-1,則v(NO2)=2v(N2O4)=2×0.00125mol•L-1•S-1=0.0025mol•L-1•S-1,故答案為:0.0025;
②反應達到60s時達到化學平衡狀態,N2O4的物質的量不再變化,
根據反應方程式計算:2NO2 ?N2O4
初始:0.4mol 0
轉化:0.16mol 0.08mol
平衡:0.24mol 0.08mol
則平衡后四氧化二氮的體積分數為=$\frac{n(N{\;}_{2}O{\;}_{4})}{n(總)}$×100%=$\frac{0.08}{0.24+0.08}$×100%=25%,
故答案為:25%;
③恒溫下如向該密閉容器中再充入0.32molHe氣,并把容器體積擴大為4L,則二氧化氮和四氧化二氮的濃度都減小,相當于減小壓強,所以V(正)、V(逆)速率都減小,平衡向逆反應方向移動,V(正)<V(逆),故選:BC.
點評 本題考查反應熱的有關計算、平衡常數意義、化學平衡移動以及相關計算,題目較為綜合,涉及多方面的知識,難度較大,試題側重對學生能力的培養和解題方法的指導與訓練,旨在考查學生靈活運用基礎知識解決實際問題的能力.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1g H2和8 gO2 | |
| B. | 0.1mol HCl 和2.24 L He | |
| C. | 150℃,1.01×105Pa時,18LH2O和18LCO2 | |
| D. | 常溫常壓下28gCO和6.02×1022個CO分子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
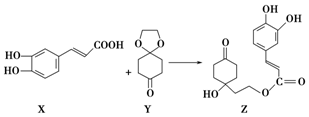
| A. | X的分子式為C9H8O4 | |
| B. | Y、Z中均含1個手性碳原子 | |
| C. | Z能發生加成反應、取代反應及消去反應 | |
| D. | 1 mol Z至多可與3 mol Br2發生取代反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 480mL | B. | 1000mL | C. | 100mL | D. | 500mL |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分解反應 | B. | 置換反應 | C. | 復分解反應 | D. | 化合反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.46 | 1.0 | 1.0 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com