
 無機化合物可根據其組成和性質進行分類
無機化合物可根據其組成和性質進行分類| 物質類別 | 酸 | 堿 | 鹽 | 氧化物 | 氫化物 |
| 化學式 | ①HCl②H2SO4 | ③NaOH ④Ba(OH)2 | ⑤Na2CO3 ⑥K2SO4 | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
分析 (1)樹狀分類法是一種很形象的分類法,按照層次,一層一層來分,就像一棵大樹;
(2)酸電離出的陽離子全部是氫離子的化合物;堿電離出的陰離子全部為氫氧根離子;鹽電離出得陽離子為金屬離子,陰離子為酸根離子;
(3)二氧化碳和氫氧化鈉溶液反應生成碳酸鈉和水;
(4)雙氧水分解生成氧氣和水;
(5)二氧化碳和氫氧化鈉反應生成碳酸鈉和水;
(6)反應Cu+4HNO3(稀)═Cu(NO3)2+2NO2↑+2H2O中,1mol銅失去2mol電子,做還原劑,2mol硝酸得電子被還原,做氧化劑;19.2g銅的物質的量為0.3mol,根據1molCu~2mol硝酸可求出當0.3mol銅反應時被還原的硝酸的物質的量.
解答 解:(1)樹狀分類法是一種很形象的分類法,按照層次,一層一層來分,就像一棵大樹,有葉、枝、桿、根,圖示方法就是樹狀圖,故答案為:樹狀分類法;
(2)酸電離出的陽離子全部是氫離子的化合物,如H2SO4;堿電離出的陰離子全部為氫氧根離子,如NaOH;鹽電離出得陽離子為金屬離子,陰離子為酸根離子,如K2SO4,
故答案為:②H2SO4;③NaOH;⑥K2SO4;
(3)二氧化碳和氫氧化鈉溶液反應生成碳酸鈉和水,反應的離子方程式為:CO2+2OH-=CO32-+H2O,故答案為:CO2+2OH-=CO32-+H2O;
(4)雙氧水分解生成氧氣和水,化學方程式為:2H2O2$\frac{\underline{\;二氧化錳\;}}{\;}$2H2O+O2↑,故答案為:2H2O2$\frac{\underline{\;二氧化錳\;}}{\;}$2H2O+O2↑;
(5)二氧化碳和氫氧化鈉反應生成碳酸鈉和水,離子方程式為:2OH-+CO2=CO32-+H2O,故答案為:2OH-+CO2=CO32-+H2O;
(6)反應Cu+4HNO3(稀)═Cu(NO3)2+2NO2↑+2H2O中,1mol銅失去2mol電子,做還原劑,4mol硝酸中的2mol硝酸得電子被還原,做氧化劑,故用單線橋表示電子得失方向和數目為 ;19.2g銅的物質的量為0.3mol,設備還原的硝酸的物質的量為xmol,則有:1molCu~2molHNO3,
;19.2g銅的物質的量為0.3mol,設備還原的硝酸的物質的量為xmol,則有:1molCu~2molHNO3,
0.3mol xmol
則有:$\frac{1}{0.3}=\frac{2}{x}$
解得x=0.6mol,即被還原的硝酸為0.6mol.
而由于銅反應后變為+2價,故0.3mol銅反應后轉移0.6mol電子,即0.6NA個.
故答案為: ;硝酸;銅;0.6mol;0.6NA.
;硝酸;銅;0.6mol;0.6NA.
點評 本題考查了化學方程式和離子方程式的書寫以及氧化還原反應中得失電子的有關計算,難度不大,應注意單線橋的標示方法.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
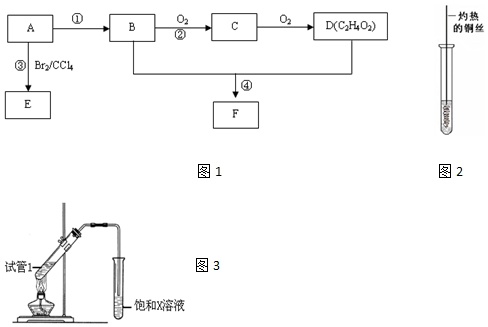
 ,D中官能團為羧基(-COOH).
,D中官能團為羧基(-COOH). CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 序號 | 金屬質量 g | 金屬狀態 | c(H2SO4) mol•L-1 | V(H2SO4) mL | 溶液溫度/℃ | 金屬消失的 時間/s | |
| 反應前 | 反應后 | ||||||
| 1 | 0.10 | 絲 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 絲 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 絲 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 絲 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 絲 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 絲 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 絲 | 1.1 | 50 | 30 | 44 | 40 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解NaCl飽和溶液,可制得金屬鈉 | |
| B. | 在海輪外殼上鑲入鋅塊,可減緩船體的腐蝕速率 | |
| C. | 尋找高效催化劑,利用太陽能分解水是制取氫氣的較理想方法 | |
| D. | MgO的熔點很高,可用于制作耐高溫材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | S→SO2→SO3→H2SO4 | B. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 | ||
| C. | Al→Al2O3→Al(OH)3→NaAlO2 | D. | N2→NO→NO2→HNO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com