
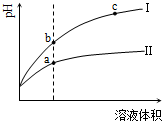
| A. | Ⅱ為鹽酸稀釋時的pH變化曲線 | |
| B. | a點Kw的數值比c點Kw的數值大 | |
| C. | b點酸的總濃度小于a點酸的總濃度 | |
| D. | b點溶液的導電性比c點溶液的導電性強 |
分析 A.CH3COOH是弱酸,在水溶液中部分電離,HCl是強電解質,在水溶液中完全電離,pH相同的醋酸和鹽酸,c(CH3COOH)>c(HCl),加水稀釋促進醋酸電離,pH相同的醋酸和鹽酸稀釋相同的倍數,pH變化大的是HCl、變化小的是醋酸;
B.離子積常數只與溫度有關,與溶液酸性強弱無關;
C.II是醋酸、I是鹽酸,pH相同的醋酸和鹽酸,c(CH3COOH)>c(HCl),加水稀釋相同的倍數,醋酸濃度仍然大于鹽酸;
D.溶液導電性與離子濃度成正比.
解答 解:A.CH3COOH是弱酸,在水溶液中部分電離,HCl是強電解質,在水溶液中完全電離,pH相同的醋酸和鹽酸,c(CH3COOH)>c(HCl),加水稀釋促進醋酸電離,pH相同的醋酸和鹽酸稀釋相同的倍數,pH變化大的是HCl、變化小的是醋酸,根據圖知,II是醋酸、I是鹽酸,故A錯誤;
B.離子積常數只與溫度有關,與溶液酸性強弱無關,a、c兩點溶液溫度相同,其離子積常數相同,故B錯誤;
C.II是醋酸、I是鹽酸,pH相同的醋酸和鹽酸,c(CH3COOH)>c(HCl),加水稀釋相同的倍數,醋酸濃度仍然大于鹽酸,故C正確;
D.溶液導電性與離子濃度成正比,根據圖知,c點pH大于b點,但b點氫離子濃度大于c點,所以b點導電能力大于c點,故D正確;
故選CD.
點評 本題以弱電解質的電離為載體考查學生識圖能力,明確弱電解質電離特點及電解質溶液導電性影響因素是解本題關鍵,側重考查學生分析判斷能力,注意:電解質溶液導電性與離子濃度成正比,與電解質強弱無關,易錯選項是D.


 計算高手系列答案
計算高手系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 物質的溶解過程,實質上就是其電離過程 | |
| B. | 二氧化硫的水溶液能導電,所以二氧化硫是電解質 | |
| C. | 1L0.1 mol•L-1的H2SO4溶液中含有0.2 molH+ | |
| D. | 1L0.1 mol•L-1的H2SO3溶液中含有0.2 molH+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
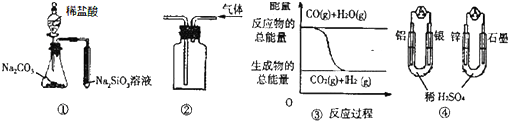
| A. | 用圖 ①所示實驗可比較氯、碳、硅三種元素的非金屬性強弱 | |
| B. | 用圖 ②所示實驗裝置排空氣法收集CO2氣體 | |
| C. | 圖 ③表示反應 CO(g)+H2O(g)?CO2(g)+H2(g)是放熱反應 | |
| D. | 圖 ④兩個裝置中通過導線的電子數相同時,消耗負極材料的物質的量也相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2-甲基-2-丁烯 | B. | 2,3-二甲基-1-丙烯 | ||
| C. | 3-甲基-1-丁烯 | D. | 2-甲基-1,3-丁二烯 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com