
 硫酸工業用SO2制取SO3的反應為:2SO2+O2 $?_{加熱}^{催化劑}$2SO3△H=-47kJ/mol.不同溫度下,反應的平衡常數如表:
硫酸工業用SO2制取SO3的反應為:2SO2+O2 $?_{加熱}^{催化劑}$2SO3△H=-47kJ/mol.不同溫度下,反應的平衡常數如表:| 溫 度 | 200℃300℃400℃ |
| 平衡常數 | K1 K2 K3 |
分析 (1)根據平衡常數等于生成物的濃度冪之積除以反應物的濃度冪之積;
(2)當反應達到平衡狀態時,正逆反應速率相等,各物質的濃度、百分含量不變,以及由此衍生的一些量也不發生變化,據此解答,解題時要注意,選擇判斷的物理量,隨著反應的進行發生變化,當該物理量由變化到定值時,說明可逆反應到達平衡狀態;
(3)根據可逆反應的特點進行判斷;
(4)根據等效平衡進行計算;
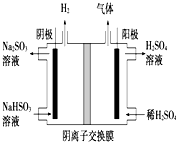
(5)陽極上陰離子失去電子發生氧化反應,且酸與亞硫酸氫根離子反應.
解答 解:(1)2SO2+O2 $?_{加熱}^{催化劑}$2SO3,K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$,故答案為:K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$;
(2)a.v正(O2)=2v逆(SO3),反應速率之比與化學計量數之比不等,故a錯誤;
b.平均分子量=$\frac{總質量}{總物質的量}$,總質量一定,總物質的量會變,故容器中氣體的平均分子量不隨時間而變化能說明到達平衡狀態,故b正確;
c.隨反應進行氣體的質量不變,容器的體積也不變,故容器中氣體的密度不隨時間而變化不能說明到達平衡狀態,故c錯誤;
d.隨反應進行氣體的分子數減少,故容器中氣體的分子總數不隨時間而變化能說明到達平衡狀態,故d正確;
故答案為:bd;
(3)2SO2(g)+O2(g)?2SO3(g)的平衡體系中加入18O2,由于反應是可逆反應,所以達到新的平衡后18O2出現在SO2、O2與SO3中,故SO2中18O的百分含量增加,
故答案為:增加;該反應是可逆反應,在SO2和18O2反應生成S18O3的同時,S18O3又分解生成S18O2;
(4)2SO2(g)+O2(g)?2SO3
Ⅰ2mol 1mol 0
Ⅱa b c
當SO2和SO3的物質的量之和為2 mol時,才能保證反應初始SO2的物質的量為2mol,即a+c=2mol,此時要求O2為1mol,那么就有b+0.5c=1mol.
滿足此兩條件方可使平衡與原平衡為等效平衡,
故答案為:a+c=2;2b+c=2;
(5)陽極電極是氫氧根離子放電,陽極反應為4OH--4e-=2H2O+O2、HSO3--2e-+H2O=3H++SO42-,且部分亞硫酸氫根離子會和氫離子反應生成二氧化硫氣體,
故答案為:4OH--4e-=2H2O+O2;O2、SO2.
點評 本題考查影響化學平衡移動的因素、平衡狀態的判斷、平衡常數表達式、等效平衡、電極反應式的書寫等知識點,難度較大.要注意等效平衡的條件.


 津橋教育計算小狀元系列答案
津橋教育計算小狀元系列答案科目:高中化學 來源: 題型:選擇題
| A. | 進入煤礦礦井時用火把照明 | |
| B. | 實驗室在通風櫥中制備氯氣 | |
| C. | 將水倒入濃硫酸配制稀硫酸 | |
| D. | 用點燃的火柴在液化氣鋼瓶口檢驗是否漏氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,22gCO2氣體中所含分子數大于0.5NA | |
| B. | 1LCO2和1LCO所含分子數相同 | |
| C. | 等質量的O2和O3,所含的原子數一定相等 | |
| D. | 1mol•L-1的NaOH溶液中Na+數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 恒溫恒壓下,若混合氣體密度不變,說明反應已達平衡 | |
| B. | 恒容時通入氬氣,壓強不變,正逆反應速率也不變 | |
| C. | 降低溫度可以縮短反應達到平衡的時間 | |
| D. | 恒容時通入X2,平衡向正反應方向移動,平衡常數不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 堿性氧化物均為金屬氧化物 | |
| B. | 一種元素可能有多種氧化物,但是同種化合價只對應一種氧化物 | |
| C. | 酸根離子中不可能含有金屬元素 | |
| D. | 還原產物只有還原性,氧化產物只有氧化性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
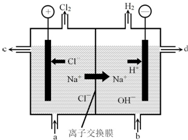 氯堿工業以電解精制飽和食鹽水的方法制取氯氣、氫氣、燒堿和氯的含氧酸鹽等系列化工產品.
氯堿工業以電解精制飽和食鹽水的方法制取氯氣、氫氣、燒堿和氯的含氧酸鹽等系列化工產品.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素 | 相關信息 |
| X | X的基態原子核外3個能級上有電子,且每個能級上的電子數相等 |
| Y | M層上有2對成對電子 |
| Z | Z和Y同周期,Z的電負性大于Y |
| W | W的一種核素的質量數為63,中子數為34 |
| J | J的氣態氫化物與J的最高價氧化物對應的水化物可反應生成一種鹽 |
 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com