
【題目】工業上以軟錳礦(主要成分為MnO2) 為主要原料制備高錳酸鉀(KMnO4)的工藝流程如下:
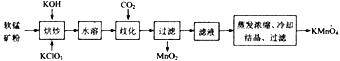
回答下列問題:
(1)原料軟錳礦在使用之前通常需粉碎,其目的是_________________________________。
(2)“烘炒”時是將混合物放入某種材質的坩堝內,混合均勻,小火加熱至熔融,有K2MnO4和KCl生成,則烘炒過程中發生反應的化學方程式為________________;“烘炒”時所用坩堝的材質可以選用_______(填字母)。
a.石英 b.氧化鋁 c.硅酸鹽陶瓷 d.鐵
(3)已知水溶過程中無化學反應發生,通入CO2使反應體系呈中性或弱酸性即可發生歧化反應,則歧化時發生反應的氧化產物與還原產物的物質的量之比為_______________。
(4)對濾液進行蒸發濃縮時,溫度不宜超過60℃,其原因是_________________;將蒸發溫度控制在60℃左右的最佳操作方法是_______________________。
(5)流程中可以循環利用的物質是___________________。
(6)用CO2歧化法將K2MnO4轉化為KMnO4屬于傳統工藝,現代工藝多采用電解法,即電解K2MnO4水溶液,電解槽中陽極發生的電極反應為_________________;與“CO2歧化法”相比,“電解法”的顯著優點是____________________。
【答案】 增大反應物的接觸面,加快化學反應速率;提高原料的利用率 3MnO2 + 6KOH + KClO3 ![]() 3K2MnO4 + KCl + 3H2O d 2∶1 防止溫度過高導致KMnO4分解 水浴加熱 MnO2 MnO42--e- = MnO4- KMnO4的純度高、產率高
3K2MnO4 + KCl + 3H2O d 2∶1 防止溫度過高導致KMnO4分解 水浴加熱 MnO2 MnO42--e- = MnO4- KMnO4的純度高、產率高
【解析】(1)工業生產中將原料粉碎的目的一般是為了增大反應物的接觸面積,加快反應速率,同時盡量將更多的原料轉化為產物,以提高原料的利用率。
(2)“烘炒”時將MnO2、KClO3和KOH轉化為K2MnO4和KCl,方程式為:3MnO2 + 6KOH + KClO3 ![]() 3K2MnO4 + KCl + 3H2O。因為過程中加入了氫氧化鉀這樣的強堿,所以能與強堿反應的物質都不能使用,例如,石英(二氧化硅)、氧化鋁和陶瓷(其中含有二氧化硅),所以只能使用鐵坩堝,選項d正確。
3K2MnO4 + KCl + 3H2O。因為過程中加入了氫氧化鉀這樣的強堿,所以能與強堿反應的物質都不能使用,例如,石英(二氧化硅)、氧化鋁和陶瓷(其中含有二氧化硅),所以只能使用鐵坩堝,選項d正確。
(3)向溶液中通入二氧化碳時,應該是K2MnO4發生歧化,其中的Mn的化合價一部分升高一部分降低,得到KMnO4和MnO2,方程式為3K2MnO4 + 4CO2 + 2H2O = 2KMnO4 + MnO2↓ + 4KHCO3,所以氧化產物(KMnO4)與還原產物(MnO2)的物質的量之比為2:1。
(4)高錳酸鉀在較高溫度會發生分解反應,所以蒸發濃縮的時候,溫度不宜過高。蒸發溫度為60℃,低于水的沸點,所以比較合適的方法是水浴加熱。
(5)在過濾這一步得到的MnO2可以加入到第一步的烘炒中,所以MnO2可以循環。
(6)電解時,將K2MnO4轉化為KMnO4,其中Mn的化合價升高,所以陽極上失電子化合價升高的反應就是:MnO42--e- = MnO4-。與“CO2歧化法”相比,“電解法”的顯著優點是將所有的錳元素都轉化為高錳酸鉀,提高了高錳酸鉀的產率,同時得到的生成物的純凈度也較高。


 名師導航單元期末沖刺100分系列答案
名師導航單元期末沖刺100分系列答案 名校名卷單元同步訓練測試題系列答案
名校名卷單元同步訓練測試題系列答案科目:高中化學 來源: 題型:
【題目】據報道,在300℃、70MPa下由二氧化碳和氫氣合成乙醇已成為現實。2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) 下列敘述錯誤的是
CH3CH2OH(g)+3H2O(g) 下列敘述錯誤的是
A. 使用Cu-Zn-Fe催化劑可大大提高生產效率
B. 反應需在300℃進行可推測該反應是吸熱反應
C. 充入大量CO2氣體可提高H2的轉化率
D. 從平衡混合氣體中分離出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸亞鐵銨又稱莫爾鹽,是淺綠色晶體.它在空氣中比一般亞鐵鹽穩定,是常用的Fe2+試劑.某實驗小組利用工業廢鐵屑制取莫爾鹽,并測定其純度.
已知:①
| 10 | 20 | 30 | 40 | 50 | 70 |
(NH4)2SO4 | 73.3 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
FeSO47H2O | 40.0 | 48.0 | 60.0 | 73.3 | ﹣ | ﹣ |
(NH4)2SO4FeSO46H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
②莫爾鹽在乙醇溶劑中難溶.
Ⅰ.莫爾鹽的制取

試分析:
(1)必須在鐵屑少量剩余時進行過濾,其原因是______________________.
(2)步驟3中包含的實驗操作名稱_____________________.
(3)產品莫爾鹽最后用______________________ 洗滌(填字母編號).
a.蒸餾水 b.乙醇 c.濾液
Ⅱ.為測定硫酸亞鐵銨(NH4)2SO4FeSO46H2O晶體純度,某學生取m g硫酸亞鐵銨樣品配制成500mL溶液。根據物質組成甲、乙、丙三位同學設計了如下三個實驗方案,請回答:
方案一:取20.00mL硫酸亞鐵銨溶液用0.1000molL﹣1的酸性KMnO4溶液分三次進行滴定.
方案二:取20.00mL硫酸亞鐵銨溶液進行如下實驗.
![]()
(4)若實驗操作都正確,但方案一的測定結果總是小于方案二,其可能原因為_________,驗證推測的方法為:___________________________________________方案三:(通過NH4+測定)實驗設計圖如下所示.取20.00mL硫酸亞鐵銨溶液進行該實驗.

(5)裝置___________ (填“甲”或“乙”)較為合理,判斷理由是_______________.
(6)量氣管中最佳試劑是__________ (填字母編號.如選“乙”則填此空,如選“甲”此空可不填).
a.水 b.飽和NaHCO3溶液 c.CCl4
(7)若測得NH3的體積為V L(已折算為標準狀況下),則該硫酸亞鐵銨晶體的純度為_______.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】稱取兩份鋁粉,第一份加足量的NaOH溶液,第二份加足量的鹽酸,若放出等量的氣體,則兩份鋁粉的質量比為( )
A.1:1B.2:3C.1:2D.1:3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】己知反應A+3B=2C+D,在某段時間內以A的濃度變化表示的化學反應速率為1 mol/(L.min),則此段時間內以C的濃度變化表示的化學反應速率為( )
A.0.5 mol/(L·min)B.1 mol/(L·min)C.2 mol/(L·min)D.3 mol/(L·min)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在25℃、101 kPa下,1 g甲醇燃燒生成CO2和液態水時放熱22.68 kJ,下列熱化學方程式正確的是( )
A. CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l);ΔH=" +725.8" kJ/mol
O2(g)===CO2(g)+2H2O(l);ΔH=" +725.8" kJ/mol
B. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -1452 kJ/mol
C. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -725.8 kJ/mol
D. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=" +1452" kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度時,在一個2L的密閉容器中,X、Y、Z三種氣態物質的物質的量隨時間的變化曲線如圖所示。根據圖中數據,試填寫下列空白:

(1)該反應的化學方程式為_______________________;
(2)從開始至2min,Z的平均反應速率為___________;
(3)反應達平衡時,體系的壓強是開始時的____________倍。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“冰,水為之,而寒于水”關于水凝結成冰的過程的描述正確的是( )
A. △H > 0 ,△S > 0 B. △H > 0 ,△S < 0
C. △H < 0 ,△S > 0 D. △H < 0 ,△S < 0
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com