
| A. | FeO | B. | Fe3O4 | ||
| C. | Fe2O3 | D. | Fe3O4 和Fe2O3混合物 |
分析 12.5g沉淀為碳酸鈣,根據n=$\frac{m}{M}$計算碳酸鈣物質的量,進而計算二氧化碳的物質的量,CO獲得氧化物中O原子轉化為CO2,據此計算氧化物中氧原子物質的量,進而計算Fe原子物質的量,根據Fe、O原子數目之比判斷.
解答 解:12.5g沉淀為碳酸鈣,其物質的量為$\frac{12.5g}{100g/mol}$=0.125mol,由碳元素守恒可知,二氧化碳的物質的量為0.125mol,CO獲得氧化物中O原子轉化為CO2,故氧化物中n(O)=n(CO2)=0.125mol,則m(O)=0.125mol×16g/mol=2g,故氧化物中n(Fe)=$\frac{9g-2g}{56g/mol}$=0.125mol,n(Fe):n(O)=0.125mol:0.125mol=1:1,故氧化物為FeO,故選A.
點評 本題考查混合物反應有關計算,根據守恒法計算Fe、O原子數目之比,側重考查學生分析計算能力,難度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源:2016-2017學年江西省高二上月考一化學試卷(解析版) 題型:填空題
硫酸生產中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g)△H<0
2SO3(g)△H<0
(1)如果2min內SO2的 濃度由6mol/L下降為2mol/L,那么,用O2濃度變化來表示的反應速率為 .
濃度由6mol/L下降為2mol/L,那么,用O2濃度變化來表示的反應速率為 .
(2)某溫度下,SO2的平衡轉化率(α)與體系總壓強(p)的關系如圖1所示.根據圖示回答下列問題:
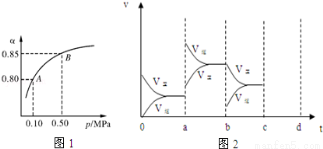
平衡狀態由A變到B時平衡常數K(A) K(B)(填“>”、“<”或“=”).
(3)此反應在恒溫密閉的裝置中進行,能充分說明此反應已達到平衡的標志是 (填字母).
A.接觸室中氣體的平均相對分子質量不再改變
B.接觸室中SO2、O2、SO3的濃度相同
C.接觸室中SO2、SO3的物質的量之比為2:1:2
D.接觸室中壓強不隨時間變化而變化
(4)圖2表示該反應在密閉容器中達到平衡時,由于條件改變而引起反應速度和化學平衡的變化情況,a~ b過程中改變的條件可能是 ;b~c過程中改變的條件可能是 ; 若增大壓強時,請把反應速率變化情況畫在c~d處.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
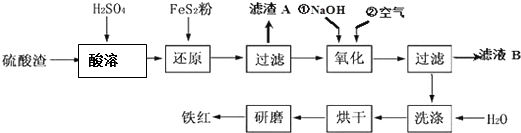
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 開始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
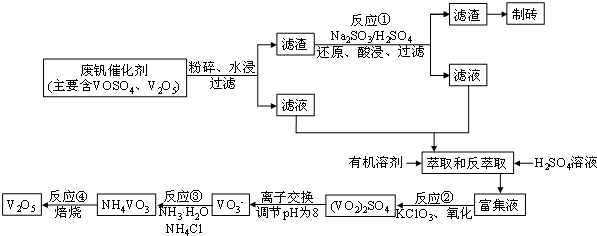
| 物質 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 難溶 | 難溶 | 易溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
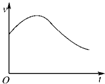 氯酸鉀和亞硫酸氫鈉發生氧化還原反應生成Cl(-1價)和S(+6價)的速率如圖所示,已知這個反應速率隨著溶液中c(H+)增大而加快.
氯酸鉀和亞硫酸氫鈉發生氧化還原反應生成Cl(-1價)和S(+6價)的速率如圖所示,已知這個反應速率隨著溶液中c(H+)增大而加快.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;
;查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖北省高二上月考一化學卷(解析版) 題型:選擇題
一定條件下,溶液的酸堿性對TiO2光催化染料R降解反應的影響如圖所示。下列判斷正確的是
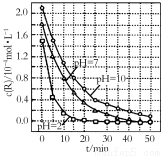
A.R的起始濃度越小,降解速率越大
B.在0~50 min之間,pH=2和pH=7時R的降解百分率相等
C.溶液酸性越 強,R的降解速率越小
強,R的降解速率越小
D.在20~25 min之間,pH=10時R的平均降解速率為0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 稀硫酸滴在銅片上:Cu+2H+═Cu2++H2↑ | |
| B. | 除去CO2中的SO2:SO2+CO32-═CO2↑+SO32- | |
| C. | 0.01 mol SO2氣體通入10 mL 1 mol/L的NaOH溶液中:SO2+OH-═HSO3- | |
| D. | 氫氧化鋇溶液與稀硫酸反應:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com