
| 鍵長/(pm) | B-F | B-Cl | B-Br |
| 計算值 | 152 | 187 | 199 |
| 實測值 | 130 | 175 | 187 |
分析 (1)與銅同周期、基態原子最外層電子數相同的過渡元素,為24號元素Cr,位于周期表中d區,其基態原子的電子排布式為[Ar]3d54s1;
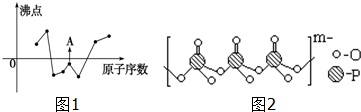
(2)圖中曲線表示8種元素的原子序數(按遞增順序連續排列)和單質沸點的關系,A以及前面的2種單質的沸點都低于0℃,則連續3種均為氣體單質,根據周期表分析;
(3)根據鮑林(Pauling)的雜化軌道理論:價層電子對個數=σ鍵個數+孤電子對個數,σ鍵個數=配原子個數,孤電子對個數=$\frac{1}{2}$×(a-xb),a指中心原子價電子個數,x指配原子個數,b指配原子形成穩定結構需要的電子個數,根據價層電子對互斥理論確定其空間構型;sp3雜化,無孤電子對數,空間構型都是正四面體形;有一對孤電子對,空間構型是三角錐型;有兩對孤電子,所以分子空間構型為V形;sp2雜化,無孤電子對數,空間構型是平面三角形;sp雜化,無孤電子對數,空間構型都是直線形;硼鹵鍵長實測值比計算值要短得多,可能的原因是B與X原子間還有π鍵形成;
(4)①根據價層電子對互斥理論確定其雜化方式,
②由給出的多聚磷酸根結構式知,含有n個多聚磷酸根離子,相當于是n個磷酸根離子中去掉了(n-1)氧原子,從而確定分子式;
(5)氫鍵結合的通式,可用X-H…Y表示.式中X和Y代表F,O,N等電負性大而原子半徑較小的非金屬原子.X和Y可以是兩種相同的元素,也可以是兩種不同的元素.
解答 解:(1)與銅同周期、基態原子最外層電子數相同的過渡元素,為24號元素Cr,位于周期表中d區,其基態原子的電子排布式為[Ar]3d54s1,
故答案為:d區;[Ar]3d54s1;
(2)圖中曲線表示8種元素的原子序數(按遞增順序連續排列)和單質沸點的關系,A以及前面的2種單質的沸點都低于0℃,則連續3種均為氣體單質,在周期表中,連續出現氣體單質的為第二周期的N、O、F,所以A為第三種氣體單質,則為F2;
故答案為:F2;
(3)BF3中B形成3個σ鍵,孤對電子數為$\frac{1}{2}$×(3-3×1)=0,為sp2雜化,立體構型為平面正三角形;硼鹵鍵長實測值比計算值要短得多,可能的原因是B-X鍵具有一定程度的雙鍵性質,在B原子上有一個空的2p軌道從三個鹵素原子上的任何一個已經充滿電子的對稱性相同的p軌道接受一對電子形成了p-pπ鍵,
故答案為:平面三角形;B與X原子間還有π鍵形成;
(4)①磷原子形成了四個σ鍵,沒有孤電子對,價電子對數為4,故呈sp3雜化,故答案為:sp3;
②由給出的多聚磷酸根結構式知,含有n個多聚磷酸根離子,相當于是n個磷酸根離子中去掉了(n-1)氧原子,所帶電荷為-2×(3n+1)+5n=-(n+2),由化合價規則知磷酸鈉的組成為Nan+1PnO3n+1,故答案為:sp3;Nan+1PnO3n+1;
(5)在HF2-中,已經存在分子內氫鍵(F-H…F-),所以沒有可用于形成分子間氫鍵的氫原子,故HF2-和HF2-微粒間不能形成氫鍵,
故答案為:在HF2-中,已經存在分子內氫鍵(F-H…F-),所以沒有可用于形成分子間氫鍵的氫原子,故HF2-和HF2-微粒間不能形成氫鍵.
點評 本題考查比較綜合,涉及周期表的應用,BF3分子的構型判斷以及有關三氯化硼分子結構知識,雜化方式的判斷、化學式的書寫以及氫鍵的形成條件及表示方法,難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 60:36 | B. | 36:60 | C. | 2:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 如圖所示,各步反應的最后產物D是一種飽和一元醇,其蒸氣密度是相同狀況下H2密度的23倍,試回答下列問題:
如圖所示,各步反應的最后產物D是一種飽和一元醇,其蒸氣密度是相同狀況下H2密度的23倍,試回答下列問題: CH2═CH2↑+H2O,⑥CH3CH2Cl+H2O
CH2═CH2↑+H2O,⑥CH3CH2Cl+H2O CH3CH2OH+HCl,⑦CH3CHO+H2
CH3CH2OH+HCl,⑦CH3CHO+H2 CH3CH2OH,⑧2CH3CH2OH+O2
CH3CH2OH,⑧2CH3CH2OH+O2 2CH3CHO+2H2O.
2CH3CHO+2H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
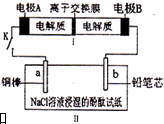 如圖所示裝置是一種可充電電池,裝置II為電解池.離子交換膜只允許Na+通過,充放電的化學方程式為2Na2S2+NaBr3$?_{充電}^{放電}$Na2S4+3NaBr.閉合開關K時,b極附近先變紅色.下列說法正確的是( )
如圖所示裝置是一種可充電電池,裝置II為電解池.離子交換膜只允許Na+通過,充放電的化學方程式為2Na2S2+NaBr3$?_{充電}^{放電}$Na2S4+3NaBr.閉合開關K時,b極附近先變紅色.下列說法正確的是( )| A. | 負極反應為2S22--2e-=S42- | |
| B. | 當有0.01 mol Na+通過離子交換膜時,b電極上析出氣體112 mL | |
| C. | 閉合K后,b電極附近的pH變小 | |
| D. | 閉合K后,a電極上有氣體產生 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
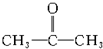 的官能團為
的官能團為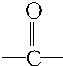 ,屬于酮類物質,這兩種物質的分子式為C3H6O,它們的關系是同分異構體.
,屬于酮類物質,這兩種物質的分子式為C3H6O,它們的關系是同分異構體.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ⑤⑥⑦ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com