
| 1 |
| 3 |
| 1 |
| 3 |


科目:高中化學 來源: 題型:
 (2011?南京模擬)常溫下,向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1醋酸溶液,所得滴定曲線如圖所示.下列說法正確的是( )
(2011?南京模擬)常溫下,向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1醋酸溶液,所得滴定曲線如圖所示.下列說法正確的是( )查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| Cu2O |
| 時間/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |

查看答案和解析>>
科目:高中化學 來源: 題型:
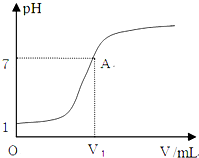 常溫下,向10mL 0.1mol?L-1HCl溶液中逐滴加入0.1mol?L-1氨水,所得滴定曲線如圖所示.下列說法正確的是( )
常溫下,向10mL 0.1mol?L-1HCl溶液中逐滴加入0.1mol?L-1氨水,所得滴定曲線如圖所示.下列說法正確的是( )| A、V1=10 mL | B、恰好中和時,溶液中:c(Cl-)≤c(NH4+) | C、A點溶液中存在:c(NH4+)=c(Cl-)=c(OH-)=c(H+) | D、當加入氨水的體積等于或小于10mL時,溶液中可能存在c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、用玻璃棒蘸取新制氯水,滴在pH試紙上,然后與比色卡對照,可測定新制氯水的pH | B、向10mL 0.1mol/L的AgNO3溶液中滴加10滴0.1mol/L的NaCl溶液,有白色沉淀生成,再向其中滴加0.1mol/L的KI溶液,沉淀變為黃色,說明相同溫度下AgCl溶解度小于AgI的溶解度 | C、向1mL 1%的NaOH溶液中加入2mL 2%的CuSO4溶液,振蕩,再加入0.5mL有機物Y,加熱,未出現磚紅色沉淀,說明Y中不含醛基 | D、取少量鹵代烴Y在堿性溶液中水解,用硝酸酸化至酸性,再滴加AgNO3溶液,生成淡黃色沉淀,說明鹵代烴中含有溴元素 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com