
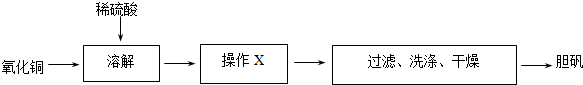
分析 (1)銅粉與稀硫酸、稀硝酸反應生成硫酸銅溶液,如得到膽礬,應將溶液進行蒸發濃縮、冷卻結晶操作,然后經過濾、洗滌、干燥可得到晶體;
(2)過濾操作中需要玻璃儀器除了燒杯、漏斗還需要玻璃棒;
(3)①計算CuO的物質的量,結合銅元素質量守恒可計算CuSO4•5H2O的質量;
②根據硫酸根守恒計算稀硫酸的物質的量的濃度.
解答 解:(1)銅粉與稀硫酸、稀硝酸反應生成硫酸銅溶液,如得到膽礬,應將溶液進行蒸發濃縮、冷卻結晶操作,然后經過濾、洗滌、干燥可得到晶體,
故答案為:蒸發濃縮、冷卻結晶;
(2)過濾操作中需要玻璃儀器除了燒杯、漏斗還需要玻璃棒,故答案為:玻璃棒;
(3)①n(CuO)=$\frac{48g}{80g/mol}$=0.6mol,則根據銅守恒,所以理論上生成膽礬的質量為0.6mol×250g/mol=150g,答:理論上生成膽礬的質量為150g;
②根據銅守恒生成0.6molCuSO4,又硫酸根守恒,所以n(H2SO4)=0.6mol,則稀硫酸的物質的量的濃度是$\frac{0.6mol}{0.3L}$=2mol/L,
答:原稀硫酸的物質的量的濃度是2mol/L.
點評 本題考查物質的分離、提純的實驗綜合應用,為高頻考點,側重于學生的分析能力、實驗能力和計算能力的考查,主要把握實驗的原理、操作方法以及守恒法應用于化學方程式的計算,難度中等.


 中考解讀考點精練系列答案
中考解讀考點精練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 早晨的樹林里會看到太陽透過樹葉射出的美麗光束 | |
| B. | 渾濁的水可以用明礬凈化 | |
| C. | 向FeCl3溶液中加入NaOH溶液,會出現紅褐色沉淀 | |
| D. | 尿毒癥患者做“血液透析” |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
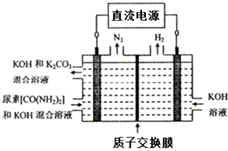 工業上常用CO2和NH3通過如下反應合成尿素[CO(NH2)2].
工業上常用CO2和NH3通過如下反應合成尿素[CO(NH2)2].| 時間/min | 0 | 20 | 70 | 80 | 100 |
| 萬(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
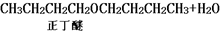
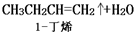
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸點(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |
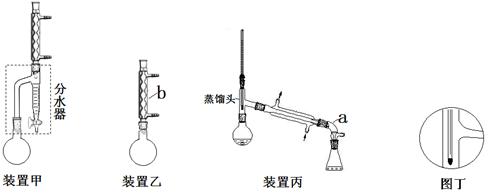


查看答案和解析>>
科目:高中化學 來源: 題型:解答題
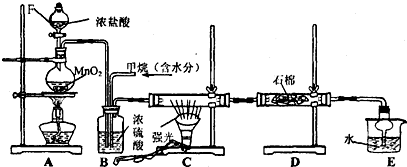
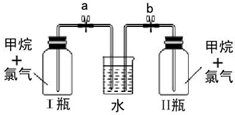
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 阿司匹林(乙酰水楊酸,)是世界上應用最廣泛的解熱、鎮痛和抗炎藥.乙酰水楊酸受熱易分解,分解溫度為128℃~135℃.某學習小組在實驗室以水楊酸(鄰羥基苯甲酸)與醋酸酐[(CH3CO)2O]為主要原料合成阿司匹林,反應原理如下:
阿司匹林(乙酰水楊酸,)是世界上應用最廣泛的解熱、鎮痛和抗炎藥.乙酰水楊酸受熱易分解,分解溫度為128℃~135℃.某學習小組在實驗室以水楊酸(鄰羥基苯甲酸)與醋酸酐[(CH3CO)2O]為主要原料合成阿司匹林,反應原理如下:
| 名稱 | 相對分子質量 | 熔點或沸點(℃) | 水 |
| 水楊酸 | 138 | 158(熔點) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸點) | 易水解 |
| 乙酰水楊酸 | 180 | 135(熔點) | 微溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
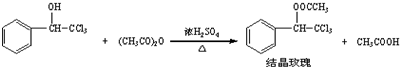
| 三氯甲基苯基甲醇 | 無色液體.不溶于水,溶于乙醇. |
| 醋酸酐 | 無色液體.溶于水形成乙酸,溶于乙醇. |
| 結晶玫瑰 | 白色至微黃色晶體.不溶于水,溶于乙醇.熔點:88℃ |
| 醋酸 | 無色的吸濕性液體,易溶于水、乙醇. |
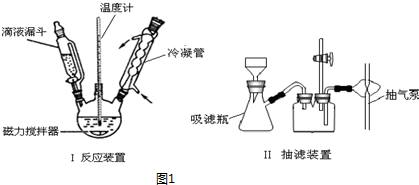
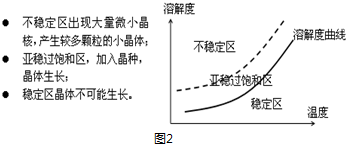
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com