
【題目】某化學興趣小組利用以下裝置探究氯氣與氨氣之間的反應。其中A、F分別為氨氣和氯氣的發生裝置,C為純凈干燥的氯氣與氨氣發生反應的裝置。
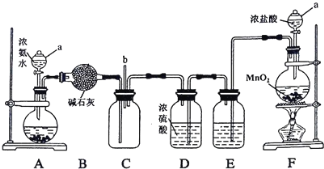
請回答下列問題:
(1)儀器a的名稱為_________;裝置A的圓底燒瓶中盛放的固體物質可選用__________(填序號)。
a.氯化鈉 b.氫氧化鈉 c.碳酸鈣
(2)裝置F的圓底燒瓶中發生反應的離子方程式為___________;裝置E的洗氣瓶中盛放的試劑為 ____________。
(3)反應過程中,裝置C的集氣瓶中有大量白煙產生,另一種產物為空氣的主要成分之一,該反應的化學方程式為 _________。
(4)從裝置C的b處逸出的尾氣中含有少量Cl2,為防止其污染環境,可將尾氣通過盛有 ________溶液的洗氣瓶。
【答案】分液漏斗 b MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 飽和氯化鈉溶液 8NH3+3Cl2=N2+6NH4Cl 氫氧化鈉
Mn2++Cl2↑+2H2O 飽和氯化鈉溶液 8NH3+3Cl2=N2+6NH4Cl 氫氧化鈉
【解析】
A裝置制備氨氣,利用B裝置中的堿石灰干燥氨氣,F裝置制備氯氣,E裝置除去氯氣中的氯化氫,D裝置干燥氯氣,在C裝置中氯氣氧化氨氣,據此解答。
(1)根據儀器構造可判斷儀器a的名稱為分液漏斗;a.氯化鈉與氨水不反應,不能制備氨氣;b.氫氧化鈉溶于水放熱,且增大氫氧根的濃度,可以和氨水混合制備氨氣;c.碳酸鈣與氨水不反應,不能制備氨氣;答案選b;
(2)濃鹽酸和二氧化錳在加熱條件下反應生成氯化錳、氯氣和水,反應的方程式為MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。濃鹽酸易揮發,生成的氯氣中含有氯化氫,E中裝有飽和食鹽水,食鹽水中含有氯離子,能抑制氯氣的溶解,作用為除去氯氣中混有的氯化氫;
Mn2++Cl2↑+2H2O。濃鹽酸易揮發,生成的氯氣中含有氯化氫,E中裝有飽和食鹽水,食鹽水中含有氯離子,能抑制氯氣的溶解,作用為除去氯氣中混有的氯化氫;
(3)C內出現濃厚的白煙為氯化銨,另一生成物是空氣的主要成分之一為氮氣,因此該反應的方程式為3Cl2+8NH3=N2+6NH4Cl;
(4)氯氣是有毒氣體,需要尾氣處理,則可將尾氣通過盛有氫氧化鈉溶液的洗氣瓶吸收。


 期末1卷素質教育評估卷系列答案
期末1卷素質教育評估卷系列答案科目:高中化學 來源: 題型:
【題目】H2S2O3是一種弱酸,實驗室欲用0.01 mol·L-1的Na2S2O3溶液滴定I2溶液,發生的反應為:I2+2Na2S2O32NaI+Na2S4O6,下列說法合理的是( )
A. 該滴定可選用如圖所示裝置示劑;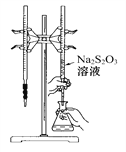
B. 該滴定可用甲基橙作指;
C. Na2S2O3是該反應的還原劑;
D. 該反應中每消耗2 mol Na2S2O3,電子轉移數為4 mol;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在25℃時,密閉容器中X、Y、Z三種氣體的初始濃度和平衡濃度如下表:
物質 | X | Y | Z |
初始濃度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡濃度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列說法錯誤的是:
A. 反應達到平衡時,X的轉化率為50% B. 反應可表示為X+3Y![]() 2Z,其平衡常數為1600 C. 增大壓強使平衡向生成Z的方向移動,平衡常數增大 D. 改變溫度可以改變此反應的平衡常數
2Z,其平衡常數為1600 C. 增大壓強使平衡向生成Z的方向移動,平衡常數增大 D. 改變溫度可以改變此反應的平衡常數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Q、R、X、Y、Z、L六種元素的原子序數依次增大,R和L是同主族元素,R的最外層電子數比次外層電子數少1,L的單質常溫常壓下是紫黑色固體。Q和X形成的離子化合物XQ是堿石灰的主要成分。X、Y、Z位于同一周期,Y的外圍電子數是最外層電子數的6倍,Z位于ds區且不能和稀硫酸反應生成H2。請回答下列問題:
(1)Q的價層電子排布式為___________________,L的含氧酸HLO3中L的雜化方式為__________,酸根LO3-的離子構型為________________。
(2)ZR42-的配體是______,在ZSO4溶液中加入過量KCN,生成配合物[Z(CN)4]2—,則1mol該配合物中含有的π鍵的數目是_______。與Z同周期的元素中,與Z原子最外層電子數相等的元素還有_________(填元素符號)
(3)Y的氧化物呈如下圖所示的無限鏈狀結構,則該氧化物的化學式為______________。

(4)X和Z的晶體堆積模型相同,配位數為______________,已知X原子半徑約為200pm,則晶體X的密度為__________________g/cm3(計算結果保留兩位有效數字)。
(5)XL2晶體含有層狀結構,其層內有強極性共價鍵,層間以范德華力相連接,則XL2的晶體類型是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D四種元素,它們原子的核電荷數均小于18,且依次增大,A原子核內僅有一個質子;B原子的電子總數與D原子的最外層電子數相等;A原子與B原子最外層電子數之和與C原子的最外層電子數相等;D原子有兩個電子層,最外層電子數是次外層電子數的3倍。
(1)試推斷它們各是什么元素?寫出它們的元素符號:
A________,B___________,C__________,D___________。
(2)甲、乙、丙、丁均含有以上元素中的一種或幾種組成的10電子微粒;
①甲為分子,且能刻蝕玻璃,則甲的化學式為______
②乙為氣體,且遇到無色酚酞溶液變成紅色,則乙的化學式為_______
③丙為陽離子,丁為陰離子,且丙和丁在加熱條件下生成的兩種物質也是10電子微粒,請寫出該反應離子方式________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與社會、環境密切相關。如圖為霧霾的主要成分示意圖。下列說法不正確的是

A. 霧屬于膠體,能產生丁達爾效應
B. SO2 和 N xOy 都屬于酸性氧化物
C. 汽車尾氣的大量排放是造成霧霾天氣的人為因素之一
D. 重金屬離子可導致蛋白質變性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是Zn和Cu形成的原電池,某實驗興趣小組做完實驗后,在讀書卡片上記錄如下,其中正確的是( )
①Zn為正極,Cu為負極;
②H+向負極移動;
③電子是由Zn經外電路流向Cu;
④Cu極上有H2產生;
⑤若有1mol電子流過導線,則產生的H2為0.5mol;
⑥正極的電極反應式為Zn﹣2e﹣═Zn2+.

A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某條件下,合成氨反應的數據如下:N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
N2 | H2 | NH3 | |
起始濃度(mol/L) | 1.0 | 3.0 | 0.2 |
2s末濃度(mol/L) | 0.6 | 1.8 | 1.0 |
4s末濃度(mol/L) | 0.4 | 1.2 | 1.4 |
當用氨氣濃度的增加來表示該反應的化學反應速率時,下列說法錯誤的是( )
A. 2~4 s內的平均反應速率為0.2 mol·L-1·s-1
B. 前4 s內的平均反應速率為0.3 mol·L-1·s-1
C. 前2 s內的平均反應速率為0.4 mol·L-1·s-1
D. 2 s末的反應速率為0.4 mol·L-1·s-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com