
| 鍵 | C-C | C-H | O=O | H-O | C-O | C=O |
| 鍵能/(kJ•mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
| 實驗編號 | 實驗步驟 | 實驗現象 |
| 1 | 向4mL無水乙醇中加入1mL溴水,充分振蕩,靜置4小時 | 溶液橙黃色褪去,溶液接近無色 |
| 2 | 向4mL無水乙醇中加入1mL溴水,加熱至沸騰 | 開始現象不明顯,沸騰后溶液迅速褪色 |
| 向淀粉KI溶液中滴加冷卻后的上述混合液 | 溶液顏色不變 | |
| 3 | 向4mL水中加入1mL溴水,加熱至沸騰 | 橙黃色略變淺 |
| 向淀粉KI溶液中滴加冷卻后的溴水混合液 | 溶液變藍 |
分析 Ⅰ反應熱=反應物總鍵能-生成物總鍵能,注明物質的聚集狀態與焓變書寫熱化學方程式;
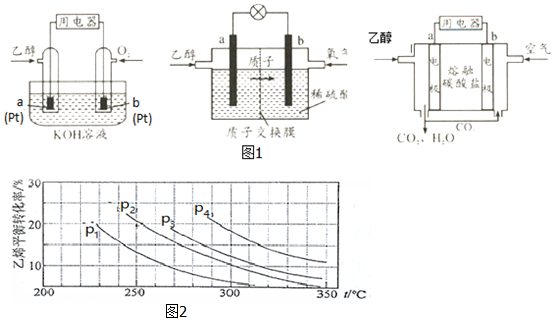
Ⅱ(1)正極上O2得電子發生還原反應;
(2)負極上燃料失電子發生氧化反應,空氣中的CO2會與KOH溶液反應,降低溶液的堿性,同時反應中也會消耗KOH;
(3)電池的兩極分別充入乙醇和氧氣,形成原電池反應時,乙醇被氧化,應為負極,b為正極,通過質子交換膜的離子是H+;
(4)原電池中陰離子向負極移動,電極b上發生還原反應;
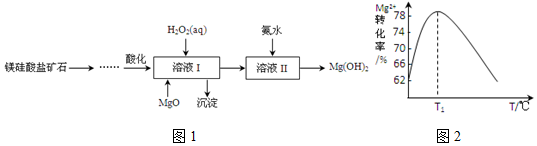
Ⅲ(1)在相同溫度下由于乙烯轉化率為p1<p2<p3<p4,正反應為氣體體積減小的反應,增大壓強平衡向正反應分析移動,乙烯的轉化率增大;
(2)若要進一步提高乙烯轉化率,除了可以適當改變反應溫度和壓強外,還可以改變物質的濃度;
Ⅳ(1)①檢驗反應后溶液中是否還含有溴單質;
②實驗3的作用是對比實驗,驗證在加熱條件下水是否能夠與溴單質反應;
③根據實驗現象得出的結論是加熱條件下或長期放置,乙醇能夠與溴水反應;
(2)根據發生氧化反應,則Br2全部轉化為HBr,發生取代反應,則Br2一半轉化為HBr.
解答 解:Ⅰ反應熱=反應物總鍵能-生成物總鍵能,則C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H=348kJ/mol+413×5kJ/mol+351kJ/mol+463kJ/mol+498×3kJ/mol-799×2×2kJ/mol-463×2×3kJ/mol=-1253kJ/mol,故答案為:C2H5OH(g)+3O2(g)2CO2(g)+3H2O(g)△H=-1253kJ/mol
Ⅱ(1)正極發生還原反應,三種乙醇燃料電池中正極反應物均為O2,故答案為:O2;
(2)負極上乙醇失電子和水反應生成二氧化碳和氫離子,電極反應式為CH3CH2OH-12e-+3H2O=2CO2+12H+,空氣中的CO2會與KOH溶液反應,降低溶液的堿性,同時反應中也會消耗KOH,故答案為:CH3CH2OH-12e-+3H2O=2CO2+12H+;空氣中的CO2會與KOH溶液反應,降低溶液的堿性,同時反應中也會消耗KOH;
(3)電池的兩極分別充入乙醇和氧氣,形成原電池反應時,乙醇被氧化,應為負極;b為正極,正極發生O2+4H++4e-=2H2O,故答案為:O2+4H++4e-=2H2O;H+;
(4)原電池中陰離子向負極移動,所以CO32-向負極(a)移動,電極b上發生還原反應,故答案為:a;O2+2CO2+4e- 2CO32-;
Ⅲ(1)由圖可知,在相同溫度下乙烯轉化率為p1<p2<p3<p4,由C2H4(g)+H2O(g)═C2H5OH(g)△H=-45.5kJ•mol-1,可知正反應為氣體體積減小的反應,所以增大壓強,平衡正向移動,乙烯的轉化率提高,因此壓強關系是p1<p2<p3<p4,故答案為:p1<p2<p3<p4;反應分子數減少,相同溫度下,壓強升高乙烯轉化率提高;
(2)若要進一步提高乙烯轉化率,除了可以適當改變反應溫度和壓強外,還可以改變物質的濃度,如從平衡體系中將產物乙醇分離出來,或增大水蒸氣的濃度,改變二者物質的量的比等,故答案為:將產物乙醇液化移去;增加nH2O:nC2H4比;
Ⅳ(1)①檢驗反應后溶液中是否還含有溴單質,故答案為:檢驗反應后溶液中是否還含有溴單質;
②實驗3的作用是對比實驗,驗證在加熱條件下水是否能夠與溴單質反應,故答案為:對比實驗,驗證在加熱條件下水是否能夠與溴單質反應;
③根據實驗現象得出的結論是加熱條件下或長期放置,乙醇能夠與溴水反應,故答案為:加熱條件下或長期放置,乙醇能夠與溴水反應;
(2)根據發生氧化反應,則Br2全部轉化為HBr,發生取代反應,則Br2一半轉化為HBr,取含a mol Br2的溴水和足量的乙醇,混合加熱,完全反應后利用AgNO3標準液滴定測定溶液中Br-物質的量.若n(Br-)=a mol則發生取代反應;若n(Br-)=2a mol則發生氧化反應;若a mol<n(Br-)<2a mol則既發生了取代反應也發生了氧化反應.故答案為:取含a mol Br2的溴水和足量的乙醇,混合加熱,完全反應后利用AgNO3標準液滴定測定溶液中Br-物質的量.若n(Br-)=a mol則發生取代反應;若n(Br-)=2a mol則發生氧化反應;若a mol<n(Br-)<2a mol則既發生了取代反應也發生了氧化反應.
點評 本題考查了化學實驗方案的評價、官能團的性質和檢驗應用、化學方程式的書寫、壓強對平衡移動的影響、物質制取方案的比較、反應熱的計算等知識,綜合性非常強,該題是高考中的常見題型,屬于中等難度,側重于學生分析問題、解決問題、知識遷移能力的培養.


科目:高中化學 來源: 題型:選擇題
| A. | 半導體行業中有一句話:“從沙灘到用戶”,計算機芯片的材料是二氧化硅 | |
| B. | 硫酸鐵易溶于水,可作凈水劑 | |
| C. | 我國首艘航母“遼寧艦”上用于艦載機降落的攔阻索是特種鋼纜,屬于金屬材料 | |
| D. | 減少煙花爆竹的燃放,有利于降低空氣中的PM2.5含量 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
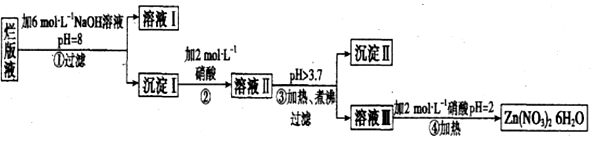
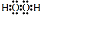 .溶液 I中加入H2O2溶液發生反應的離子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
.溶液 I中加入H2O2溶液發生反應的離子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
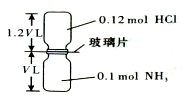 已知反應:HCl+NH3=NH4Cl(固體)如圖所示,抽去裝置中的玻璃片,使兩種氣體充分反應(整個過程中認為裝置氣密性良好),等溫度恢復到原來溫度.下列說法正確的是( )
已知反應:HCl+NH3=NH4Cl(固體)如圖所示,抽去裝置中的玻璃片,使兩種氣體充分反應(整個過程中認為裝置氣密性良好),等溫度恢復到原來溫度.下列說法正確的是( )| A. | 反應后瓶內壓強是反應前的$\frac{1}{10}$ | |
| B. | 裝置中氫元素的總質量為0.42 g | |
| C. | 生成物的分子數目為0.1 NA | |
| D. | 反應結束后,兩個集氣瓶很容易分開 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 平衡時,各容器的壓強:②=①=③ | B. | 平衡時,I2的濃度:②>①=③ | ||
| C. | 平衡時,I2的體積分數:②=①=③ | D. | 從反應開始到達平衡的時間:①>②=③ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 與等體積pH=11的NaOH溶液混合后所得溶液顯酸性 | |
| B. | c(H+)=c(CH3COO-)+c(OH-) | |
| C. | 該溶液中由水電離出的c(H+)是1.0×10-11 mol/L | |
| D. | 加入少量CH3COONa固體后,c(CH3COO-)降低 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 100mL 1mol/LAlCl3溶液 | B. | 200 mL 1mol/LMgCl2溶液 | ||
| C. | 100mL 0.5mol/LCaCl2溶液 | D. | 100 mL 2 mol/L KCl溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com