
下列實驗中,對應的現象以及結論都正確且兩者具有因果關系的是( )
選項 | 實驗 | 現象 | 結論 |
A | 用玻璃棒蘸取次氯酸鈉溶液,點在pH試紙上 | 試紙最終顯藍色 | 次氯酸鈉溶液顯堿性 |
B | 將銅粉加入1.0 mol/L Fe2(SO4)3溶液中 | 溶液變藍、有黑色固體出現 | 金屬鐵比銅活潑 |
C | 用坩堝鉗夾住一小塊用砂紙仔細打磨過的鋁箔在酒精燈上加熱 | 熔化后的液態鋁滴落下來 | 金屬鋁的熔點較低 |
D | 將0.1 mol/L MgSO4溶液滴入NaOH溶液中至不再有沉淀產生,再滴加0.1 mol/L CuSO4溶液 | 白色沉淀變為藍色沉淀 | Cu(OH)2的溶解度比Mg(OH)2的小 |
A. A B. B C. C D. D
科目:高中化學 來源:2016-2017學年重慶市高二3月月考化學試卷(解析版) 題型:選擇題
下列有關反應熱的敘述中正確的是
①己知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,則氫氣的燃燒熱為△H=-241.8kJ/mol
②由單質A轉化為單質B是一個吸熱過程,由此可知單質B比單質A穩定
③X(g)+Y(g)  Z(g)+W(s) △H>0,恒溫恒容條件下達到平衡后加入X,上述反應的△H增大
Z(g)+W(s) △H>0,恒溫恒容條件下達到平衡后加入X,上述反應的△H增大
④己知:
上表數據可以計算出 的焓變
的焓變
⑤ 根據蓋斯定律,推知在相同條件下,金剛石或石墨燃燒生成1molCO2固體時,放出的熱量相等
A. ①②③ B. ④⑤ C. ④ D. 無
查看答案和解析>>
科目:高中化學 來源:2016-2017學年陜西省西安市高一(文科班)下學期第一次教學檢測化學試卷(解析版) 題型:實驗題
某同學為探究元素周期表中元素性質的遞變規律,設計了如下系列實驗。
Ⅰ.(1)將鈉、鉀、鎂、鋁各1 mol分別投入到足量的同濃度的鹽酸中,試預測實驗結果:________與鹽酸反應最劇烈,________與鹽酸反應的速度最慢;________與鹽酸反應產生的氣體最多。
(2)向Na2S溶液中通入氯氣出現黃色渾濁,可證明Cl的非金屬性比S強,反應的離子方程式為___________________。
Ⅱ.利用下圖裝置可驗證同主族元素非金屬性的變化規律
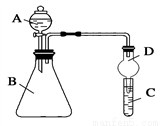
(3)上面裝置中D裝置的作用是為防止_____________。
(4)若要證明非金屬性:Cl>I,則A中加濃鹽酸,B中加KMnO4(KMnO4與濃鹽酸常溫下反應生成氯氣),C中加淀粉?碘化鉀混合溶液,觀察到C中溶液________的現象,即可證明。從環境保護的觀點考慮,此裝置缺少尾氣處理裝置,可用________溶液吸收尾氣。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年陜西省西安市高一(文科班)下學期第一次教學檢測化學試卷(解析版) 題型:選擇題
下列物質中,堿性最強的是( )
A. NaOH B. Mg(OH)2 C. Al(OH)3 D. KOH
查看答案和解析>>
科目:高中化學 來源:2017屆天津市高三畢業班聯考(一)化學試卷(解析版) 題型:簡答題
含氮的化合物廣泛存在于自然界,是一類非常重要的化合物。回答下列有關問題:
(1)在一定條件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。已知該反應的相關的化學鍵鍵能數據如下:
化學鍵 | N≡N | H-O | N-H | O=O |
E/(kJ/mol) | 946 | 463 | 391 | 496 |
則該反應的ΔH=_______________kJ/mol。
(2)在恒容密閉容器中充入2molNO2與1molO2發生反應如下:
4NO2(g)+O2(g)  2N2O5(g)
2N2O5(g)
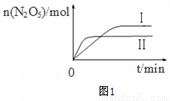
①已知在不同溫度下測得N2O5的物質的量隨時間的變化如圖1所示。常溫下,該反應能逆向自發進行,原因是_______________________。
②下列有關該反應的說法正確的是___________。
A.擴大容器體積,平衡向逆反應方向移動,混合氣體顏色變深
B.恒溫恒容,再充入2molNO2和1molO2,再次達到平衡時NO2轉化率增大
C.恒溫恒容,當容器內的密度不再改變,則反應達到平衡狀態
D.若該反應的平衡常數增大,則一定是降低了溫度
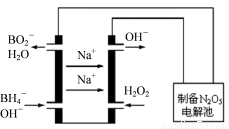
(3)N2O5是一種新型綠色硝化劑,其制備可以用硼氫化鈉燃料電池作電源,采用電解法制備得到N2O5,工作原理如圖。則硼氫化鈉燃料電池的負極反應式為 _________________________。
0.01 mol/L 的溶液 | X | Y | Z | W |
pH | 12 | 2 | 8.5 | 4.5 |
X、Y、Z、W分別是HNO3、NH4NO3、NaOH、NaNO2四種強電解質中的一種。上表是常溫下濃度均為0.01 mol/L的X、Y、Z、W溶液的pH。將X、Y、Z各1mol同時溶于水中得到混合溶液,則混合溶液中各離子的濃度由大到小的順序為_______________________。
氮的氧化物與懸浮在大氣中的海鹽粒子相互作用時,涉及如下反應:
Ⅰ:2NO2(g)+ NaCl(s) NaNO3(s)+ ClNO(g) K1
NaNO3(s)+ ClNO(g) K1
Ⅱ:2NO(g)+ Cl2(g) 2ClNO(g) K2
2ClNO(g) K2
①4NO2(g)+ 2NaCl(s) 2NaNO3(s)+ 2NO(g)+Cl2(g)的平衡常數K=_________(用K1、K2表示)
2NaNO3(s)+ 2NO(g)+Cl2(g)的平衡常數K=_________(用K1、K2表示)
②在恒溫條件下,向2L恒容密閉容器中加入0.2molNO和0.1molCl2,10min時反應Ⅱ達到平衡。測得10min內v(ClNO)=7.5×10-3mol/(L·min),則平衡時NO的轉化率α1=___________;其他條件不變,反應Ⅱ在恒壓條件下進行,平衡時NO的轉化率α2________α1(填“>” “<”或“=”)
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽師大附中高一下學期入學考試理綜化學試卷(解析版) 題型:實驗題
今有一混合溶液,只可能含有以下離子中的若干種:Na+、NH4+、Cl-、Ba2+、CO32-、SO42-、OH-,現取三份各100 mL的溶液進行如下實驗(每步實驗均僅進行完全),根據實驗內容填寫相應結論:
(1)第一份加足量NaOH溶液加熱后,收集到0.68gNH3氣體,原溶液中一定不含有________;
(2)第二份加足量BaCl2溶液后,得干燥沉淀6.27 g,經足量鹽酸洗滌、干燥后,沉淀質量為2.33 g。
綜合以上實驗,原溶液中一定含有________、________,一定不含有________;
(3)第三份加入AgNO3溶液有沉淀產生。
原溶液中還一定存在______,可能存在_______(若沒有,兩空均可不填)
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽師大附中高一下學期入學考試理綜化學試卷(解析版) 題型:選擇題
一定質量的鋁鐵合金溶于足量的NaOH溶液中,完全反應后產生3.36 L(標準狀況下)氣體;用同樣質量的鋁鐵合金完全溶于足量的鹽酸中,在標準狀況下產生5.6 L的氣體。該合金中鋁、鐵的物質的量之比為( )
A. 1∶1 B. 2∶5 C. 3∶2 D. 3∶5
查看答案和解析>>
科目:高中化學 來源:2016-2017學年寧夏學益校區高一下學期第一次(3月)月考化學試卷(解析版) 題型:選擇題
元素原子的質量數為A,Rn+核外電子數為x,則WgRn+離子所含中子數為 ( )
A. 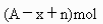 B.
B. 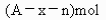
C. 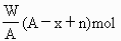 D.
D. 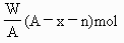
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河北省高二3月月考化學試卷(解析版) 題型:選擇題
關于有機物的描述正確的是( )
A.有機物是有生命的物質
B.有機物只能由動植物體內產生,不能用人工方法合成
C.凡是含碳元素的化合物都屬于有機物
D.在所有的有機物中都含有碳,多數含有氫,其次還含有氧、氮、鹵素、硫等。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com