
分析 氯氣溶于水發生反應Cl2+H2O?H++Cl-+HClO,加人CaCO3固體、NaHCO3固體,導致微粒濃度的變化平衡發生移動,分析次氯酸的濃度變化,由此分析解答.
解答 解:氯氣溶于水發生反應Cl2+H2O?H++Cl-+HClO,加人CaCO3固體,因為HCl>H2CO3>HClO>HCO3-,根據強制弱,碳酸鈣與生成的鹽酸和次氯酸都要反應,所以HClO的濃度減小,而NaHCO3固體只與鹽酸反應,氫離子濃度減少,平衡正向移動,次氯酸的濃度變大,故答案為:加人CaCO3固體次氯酸的濃度減小,原因是:次氯酸的酸性強于碳酸氫根離子的酸性,兩者反應消耗次氯酸;加人NaHCO3固體次氯酸的濃度增大,原因是:氫離子濃度減少,平衡正向移動,次氯酸的濃度變大.
點評 本題考查氯氣的性質,側重于學生的分析能力和元素化合物知識的綜合理解和運用的考查,為高頻考點,注意相關基礎知識的積累,難道不大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:多選題
| A. | 硫酸工業中二氧化硫的催化氧化,不采用高壓是因為壓強對SO2轉化率無影響 | |
| B. | 同溫、同濃度的鹽酸和氫氧化鈉稀溶液中,水的電離程度相同 | |
| C. | 3C(s)+CaO(s)═CaC2(s)+CO(g)在常溫下不能自發進行,說明該反應的△H>0 | |
| D. | 合成氨時,其他條件不變升高溫度,反應速率v(H2)和氫氣的平衡轉化率均增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
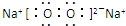 ,AB2所含化學鍵的類型:離子鍵、非極性共價鍵(極性共價鍵、非極性共價鍵、離子鍵).
,AB2所含化學鍵的類型:離子鍵、非極性共價鍵(極性共價鍵、非極性共價鍵、離子鍵).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 已知H2燃燒熱△H為-285.8kJ/mol,則:2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol | |
| B. | 已知稀鹽酸與NaOH稀溶液反應的中和熱△H為-57.3kJ/mol,則:H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-57.3kJ/mol | |
| C. | 電解稀硫酸可能發生反應:Cu+H2SO4$\frac{\underline{\;電解\;}}{\;}$CuSO4+H2↑ | |
| D. | 以石墨為電極電解MgCl2溶液的總離子方程式:2Cl-+2H2O$\frac{\underline{\;電解\;}}{\;}$H2↑+Cl2↑+2OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Z2+能促進水的電離 | |
| B. | 常見單質的熔點:X>Z>Y | |
| C. | 若元素R的某種微粒R2-,則R不一定與Y同主族 | |
| D. | Y與W組成的二元化合物是制耐高溫坩堝的常用材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下.11.2LNH3中含有N一H鍵的數目為1.5N | |
| B. | 足量的銅與含2mo1H2SO4的濃硫酸充分反應.可生成NA個SO2分子 | |
| C. | 標準狀況下.將11.2LC12通人足量的石灰乳中制備漂白粉.轉移的電子數為0.5NA | |
| D. | 常溫常壓下.21g氧氣和27g臭氧所含的氧原子總數為3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | V=40 | |
| B. | c點所示溶液中:c(H+)-c(OH-)=2c(NH3•H2O) | |
| C. | d點所示溶液中:c(NH4+)=2c(SO42-) | |
| D. | NH3•H2O的電離常數K=10-4mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 銅為陽極、銅為陰極,電解液為CuSO4溶液 | |
| B. | 石墨為陽極、鐵為陰極,電解液為CuSO4溶液 | |
| C. | 鐵為陽極,銅為陰極,電解液為AgNO3溶液 | |
| D. | 石墨為陽極,鐵為陰極,電解液為NaCl溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 工業上常用電解法制備元素C、D、E的單質 | |
| B. | 一定條件下,元素C、D的最高價氧化物對應的水化物之間不能發生反應 | |
| C. | 化合物AE與CE具有相同類型的化學鍵 | |
| D. | 元素A、B組成的化合物常溫下一定呈氣態 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com