
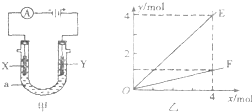
 電解原理在化學工業中有著廣泛的應用.圖甲表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連.則下列說法不正確的是( )
電解原理在化學工業中有著廣泛的應用.圖甲表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連.則下列說法不正確的是( )| A. | 若此裝置用于電解精煉銅,則X為純銅、Y為粗銅,電解的溶液a可以是硫酸銅或氯化銅溶液 | |
| B. | 按圖甲裝置用惰性電極電解AgN03溶液,若圖乙橫坐標x表示流入電極的電子的物質的量,則E可表示反應生成硝酸的物質的量,F表示電解生成氣體的物質的量 | |
| C. | 按圖甲裝置用惰性電極電解一定濃度的硫酸銅溶液,通電一段時間后,加入0.5mol的碳酸銅剛好恢復到通電前的濃度和pH,則電解過程中轉移的電子為2.0 mol | |
| D. | 若X、Y為鉑電極.a溶液為500 mL KCl和KNO3的混合液,經過一段時間后,兩極均得到標準狀況下11.2 L氣體,則原混合液中KCl的物質的量濃度至少為2.0 mol•L-1 |
分析 A、電解精煉銅粗銅作陽極,精銅陰極,電解的溶液a可以是硫酸銅或氯化銅溶液;
B、當電解硝酸銀溶液時,陽極上氫氧根離子放電生成氧氣,陰極上銀離子放電生成銀,根據轉移電子、氧氣、硝酸的關系式判斷;
C、根據“析出什么加入什么”的方法計算轉移電子的物質的量;
D、電解KCl和KNO3的混合液,陽極上氯離子放電生成氯氣,2Cl--2e-=Cl2↑,陰極上氫離子放電析出氫氣,再結合兩極上產生氣體的物質的量計算氯離子的物質的量,并計算氯化銅的物質的量,根據物質的量濃度公式計算氯化銅溶液濃度.
解答 解:A.電解精煉銅粗銅作陽極,精銅陰極,所以Y為純銅、X為粗銅,電解的溶液a可以是硫酸銅或氯化銅溶液,故A正確;
B.硝酸銀的電解方程式為:4AgNO3+2H2O$\frac{\underline{\;通電\;}}{\;}$O2↑+4HNO3+4Ag,根據方程式知,當轉移4mol電子時生成1mol氧氣,4mol硝酸,和圖象吻合,故B正確;
C.根據“析出什么加入什么”的方法知,電解硫酸銅溶液時,陰極上析出的是銅,根據原子守恒知,0.5mol的碳酸銅中銅元素的物質的量是0.5mol,陰極上的電極反應式為:Cu2++2e-=Cu,所以析出0.5mol銅需要轉移電子的物質的量是1mol,故C錯誤;
D.電解500 mL KCl和KNO3的混合液,陽極上氯離子放電生成氯氣,2Cl--2e-=Cl2↑,陰極上氫離子放電析出氫氣,兩極均得到標準狀況下11.2 L即0.5mol氣體,所以氯離子的物質的量是0.5mol,氯化鉀的物質的量是0.25mol,濃度是:$\frac{0.25mol}{0.5L}$=0.5mol/L,故D錯誤;
故選C.
點評 本題考查電解原理,明確溶液中離子放電順序是解本題關鍵,結合原子守恒、得失電子守恒來分析解答即可,難度中等.


 期末復習檢測系列答案
期末復習檢測系列答案 超能學典單元期中期末專題沖刺100分系列答案
超能學典單元期中期末專題沖刺100分系列答案 黃岡360度定制密卷系列答案
黃岡360度定制密卷系列答案 陽光考場單元測試卷系列答案
陽光考場單元測試卷系列答案 名校聯盟沖刺卷系列答案
名校聯盟沖刺卷系列答案科目:高中化學 來源: 題型:多選題
| A. | 已知P(紅磷,s)=P(白磷,s)△H>0,則白磷比紅磷穩定 | |
| B. | 測定相同物質的量濃度的Na2CO3、Na2SiO3的溶液pH,發現后者的更高,說明碳的非金屬性強于硅 | |
| C. | 溫度和壓強一定時,對于可逆反應:2NO2(g)?N2O4(g),混合氣體的密度不再改變,則反應達到平衡狀態. | |
| D. | 將NaAlO2溶液與NaHCO3溶液混合后生成白色沉淀,是兩種溶液水解相互促進的結果 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,判斷下列物質不能與B發生化學反應的有C.
,判斷下列物質不能與B發生化學反應的有C.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
. .同時滿足下列條件的B的同分異構體(不包括B)共有11種:能與FeCl3溶液顯紫色,苯環上只有兩個取代基.
.同時滿足下列條件的B的同分異構體(不包括B)共有11種:能與FeCl3溶液顯紫色,苯環上只有兩個取代基. (任寫一種).
(任寫一種). )和CH2=CH2為原料制備有機物
)和CH2=CH2為原料制備有機物  的合成路線流程圖(無機試劑任用).合成路線流程圖示例如下:
的合成路線流程圖(無機試劑任用).合成路線流程圖示例如下:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2分子的比例模型: | |
| B. | 過氧化氫的電子式: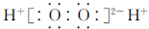 | |
| C. | 氟原子的結構示意圖: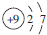 | |
| D. | H2CO3的電離方程式:H2CO3?2H++CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
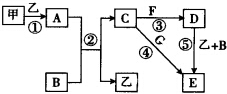 下列框圖中的物質均為中學化學中常見物質,其中甲、乙為單質,其余均為化合物.B為常見液態化合物,A為淡黃色固體,F、G所含元素相同且均為氯化物,G遇KSCN溶液顯紅色.
下列框圖中的物質均為中學化學中常見物質,其中甲、乙為單質,其余均為化合物.B為常見液態化合物,A為淡黃色固體,F、G所含元素相同且均為氯化物,G遇KSCN溶液顯紅色.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  用裝置制備Fe(OH)2并能較長時間觀察其顏色 | |
| B. |  用裝置制備并收集少量氨氣 | |
| C. |  用裝置除去H2S中的水蒸氣 | |
| D. |  用裝置制取純凈的乙酸乙酯 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;元素Z的離子結構示意圖為
;元素Z的離子結構示意圖為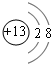 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com