
分析 (1)固體加熱時發(fā)生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,由充分反應(yīng)生成的氣體可計算混合物中NaHCO3質(zhì)量,再計算碳酸鈉的質(zhì)量;
(2)反應(yīng)后剩余固體為碳酸鈉,根據(jù)碳酸氫鈉的質(zhì)量計算出其分解生成的碳酸鈉,從而可計算出反應(yīng)后剩余固體的質(zhì)量.
解答 解:(1)設(shè)混合物中碳酸氫鈉的質(zhì)量為m,則:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
168g 106g 22.4L
m 11.2L
所以m=$\frac{11.2L×168g}{22.4L}$×168g=84g,
則混合物中碳酸鈉的質(zhì)量為:190g-84g=106g,
答:混合物中Na2CO3的質(zhì)量是106g;
(2)充分加熱后剩余固體為碳酸鈉,84g碳酸氫鈉分解生成碳酸鈉的質(zhì)量為:$\frac{84×106}{168}$g=53g,
則剩余固體的質(zhì)量為:106g+53g=159g,
答:充分反應(yīng)后,剩余固體的質(zhì)量為159g.
點評 本題考查了混合物反應(yīng)的計算,題目難度中等,明確發(fā)生反應(yīng)的實質(zhì)為解答關(guān)鍵,注意掌握物質(zhì)的量與摩爾質(zhì)量、氣體摩爾體積之間的關(guān)系,試題培養(yǎng)了學(xué)生的分析能力及化學(xué)計算能力.


科目:高中化學(xué) 來源: 題型:選擇題

| A. | 裝置①中陰極上析出紅色固體 | |
| B. | 裝置②的待鍍鐵制品應(yīng)與電源負極相連 | |
| C. | 裝置③中a為負極,發(fā)生的電極反應(yīng)式為H2+2OH-+2e-═2H2O | |
| D. | 裝置④中在陰極可以得到氫氣和氫氧化鈉,離子交換膜可選用陽離子交換膜 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
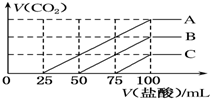 濃度相同的NaOH溶液各100mL倒入A、B、C三個燒杯中,分別向三份溶液中通入不等量的CO2,充分反應(yīng)后,再向三份所得溶液中逐滴加入0.2mol•L-1的鹽酸,產(chǎn)生CO2的體積與所加鹽酸體積之間關(guān)系如圖所示.下列判斷正確的是( )
濃度相同的NaOH溶液各100mL倒入A、B、C三個燒杯中,分別向三份溶液中通入不等量的CO2,充分反應(yīng)后,再向三份所得溶液中逐滴加入0.2mol•L-1的鹽酸,產(chǎn)生CO2的體積與所加鹽酸體積之間關(guān)系如圖所示.下列判斷正確的是( )| A. | 原NaOH溶液的濃度為0.2 mol•L-1 | |
| B. | B燒杯中通入的CO2體積為448 mL | |
| C. | 通入CO2后,不能確定A燒杯中的溶質(zhì) | |
| D. | 通入CO2后,C燒杯中溶質(zhì)成分為NaOH和 Na2CO3,且物質(zhì)的量相等 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
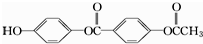
| A. | 3 mol | B. | 4mol | C. | 5 mol | D. | 6 mol |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | 硝酸的摩爾質(zhì)量是63 g | |
| B. | 1 mol CO的質(zhì)量是28 g | |
| C. | 4 g氫氣對應(yīng)的摩爾質(zhì)量是2 g氫氣對應(yīng)的摩爾質(zhì)量的2倍 | |
| D. | 鐵的摩爾質(zhì)量在數(shù)值上等于鐵原子的相對原子質(zhì)量 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
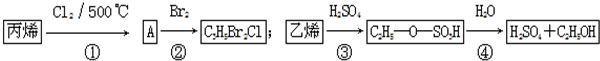
| A. | 反應(yīng)①與反應(yīng)④均是取代反應(yīng) | |
| B. | 反應(yīng)②與反應(yīng)③均是加成反應(yīng) | |
| C. | 反應(yīng)②中產(chǎn)物的結(jié)構(gòu)簡式為CH2BrCH2CHClBr | |
| D. | 反應(yīng)③、④表明硫酸是乙烯與水反應(yīng)的催化劑 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | 配置硫酸溶液時,將濃硫酸慢慢注入盛有水的容量瓶中進行配制 | |
| B. | 用托盤天平稱量8.75g NaCl固體 | |
| C. | 將混合液蒸餾分離時,應(yīng)使溫度計水銀球浸沒在混合液中 | |
| D. | 分液時,將上層液體從分液漏斗上口倒出,下層液體從分液漏斗下口放出 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com