
分析 (1)NaH與AlCl3反應可得到NaAlH4,此反應無化合價的變化,據此書寫;
(2)NaAlH4與水反應生成氫氣,應是水中的H元素與NaH中的H元素之間得失電子,據此書寫即可;
(3)由題意可知NaH常做還原劑那么鐵銹為氧化劑,反應生成鐵單質,據此書寫;
(4)制備過程中未指明吸收雜質氣體HCl,據此解答;氫氣與金屬鈉反應未指明鈉的用量,鈉可能過量,過量的鈉也可以與水反應生成氫氣.
解答 解:(1)NaH與AlCl3反應可得到NaAlH4,此反應無化合價的變化,根據原子守恒推測另一種生成物,化學反應方程式為:4NaH+AlCl3=NaAlH4+3NaCl,
故答案為:4NaH+AlCl3=NaAlH4+3NaCl;
(2)NaAlH4與水反應生成氫氣,即NaH中H化合價升高,水中H元素化合價降低,化學反應方程式為:NaAlH4+2H2O=NaAlO2+4H2↑,故答案為:NaAlH4+2H2O=NaAlO2+4H2↑;
(3)NaH常做還原劑(H化合價升高為+1價),鐵銹在此為氧化劑(Fe化合價降低為0價),反應生成鐵單質,化學反應方程式為:3NaH+Fe2O3=2Fe+3NaOH,故答案為:3NaH+Fe2O3=2Fe+3NaOH;
(4)稀鹽酸具有揮發性,且可以利用濃硫酸干燥,故制取的氫氣中可能混有雜質氣體HCl,那么制取的甲中就混有NaCl,驗證過程中未排除金屬鈉的干擾,過量的金屬能也可以與水反應生成氫氣.
故答案為:制備過程不合理,因為鹽酸易揮發,氫氣中混有HCl,導致產物中有NaCl;驗純方法不合理,如果有Na殘留,Na與水反應也產生氫氣,且沒有考慮混入的NaCl.
點評 本題主要考查的是常見元素以及其化合物的知識,綜合性較強,涉及物質的判斷、化學反應方程式書寫、實驗方案的評價等,難度較大.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素 性質 | A | B | C | D | E | F | G | H | I | J |
| 原子半徑(10-10 m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高 價態 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低 價態 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | S$\stackrel{O_{2}點燃}{→}$ SO3$\stackrel{足量氨水}{→}$(NH4)2SO4 | |
| B. | NH3$→_{加熱}^{O_{2}/催化劑}$NO$\stackrel{O_{2}}{→}$ NO2 | |
| C. | Fe$→_{加熱}^{少量Cl_{2}}$ FeCl2$→_{溶液}^{NaOH溶液}$Fe(OH)2 | |
| D. | Al$→_{溶液}^{NaOH溶液}$ NaAlO2$\stackrel{足量鹽酸}{→}$Al(OH)3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 通入氧氣的一極為正極,發生氧化反應 | |
| B. | 該電池負極的電極反應為2H2-4e-=4H+ | |
| C. | 該電池工作一段時間,電解質溶液濃度保持不變 | |
| D. | 該電池在工作時,溶液中的陰離子向負極移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
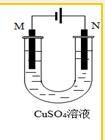
| A. | 若用于精煉粗銅,所得電解銅的純度可達99.95%~99.98% | |
| B. | 若用于精煉粗銅,在N極附近得到陽極泥,可作為提煉金、銀等貴重金屬的原料 | |
| C. | 若用于精煉粗銅,則M極為粗銅 | |
| D. | 若用于鐵片鍍銅,則M極為鐵片 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 操 作 | 現 象 |
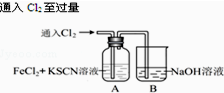 | I.A中溶液變紅 Ⅱ.稍后,溶液由紅色變為黃色 |
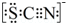 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cl-一定存在,且c(Cl-)≥0.4 mol/L | |
| B. | SO42-、NH4+一定存在,Cl-可能不存在 | |
| C. | CO32-、Al3+一定不存在,K+可能存在 | |
| D. | 至少存在5種離子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com