
【題目】化學與人類文明進步息息相關,下列說法錯誤的是( )
A. 蠶絲的主要成分是蛋白質,屬于天然高分子材料
B. 漢代燒制出“明如鏡、聲如磬”的瓷器,主要化學成分是硅酸鹽
C. 2022年冬奧會聚氨酯速滑服,是無機非金屬材料
D. 城市公交系統推廣的清潔燃料壓縮天然氣“![]() ”、液化石油氣“
”、液化石油氣“![]() ”,主要成分都是烴
”,主要成分都是烴
 鴻圖圖書寒假作業假期作業吉林大學出版社系列答案
鴻圖圖書寒假作業假期作業吉林大學出版社系列答案科目:高中化學 來源: 題型:
【題目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀鹽酸,CO2的生成量與加入鹽酸的體積(V)的關系如圖所示.下列判斷正確的是(
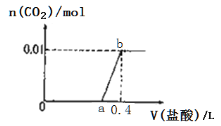
A. 在0~a范圍內,只發生中和反應
B. 原混合溶液中NaOH與Na2CO3的物質的量之比為1:2
C. a = 0.3
D. ab段發生反應的離子方程式為:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用如下裝置制取氯氣,并用氯氣進行實驗。回答下列問題:

(1)A中盛有濃鹽酸,B中盛有MnO2,寫出反應的化學方程式_______。
(2)D中放入濃H2SO4,其目的是_____________________________。
(3)E中為紅色干布條,F中為紅色濕布條,可觀察到的現象是___________,對比E和F中現象的差異可得出的結論及解釋是____________________。
(4)G處的現象是____________________________________。
(5)畫出H處尾氣吸收裝置圖并注明試劑____________。
(6)家庭中常用消毒液(主要成分NaClO)與潔廁靈(主要成分鹽酸)清潔衛生。某品牌消毒液包裝上說明如圖。
注意事項:
1、本品對棉織品有漂白脫色作用,對金屬制品有腐蝕作用。
2、密封保存,請勿與潔廁靈同時使用。
3、保質期為一年。
“與潔廁靈同時使用”會產生有毒的氯氣,寫出反應的離子方程式________。
(7)現在有一種名為“凈水丸”的產品也能對飲用水進行快速的殺菌消毒,藥丸通常分內外兩層。外層的優氯凈Cl2Na(NCO)3先與水反應,生成次氯酸起殺菌消毒作用;幾分鐘后,內層的亞硫酸鈉(Na2SO3)溶出,可將水中的余氯(次氯酸等)除去。亞硫酸鈉將水中多余次氯酸除去的離子反應方程式為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W為四種短周期主族元素,且原子序數依次增大。已知X的最外層電子數是其電子層數的2倍,Y是地殼中含量最高的元素,Y原子的最外層電子數是W原子最外層電子數的2倍,Z原子最外層只有1個電子。下列說法正確的是( )
A. 離子半徑:![]() B. Z和Y形成的化合物可能含有非極性鍵
B. Z和Y形成的化合物可能含有非極性鍵
C. 氫化物的穩定性:![]() D. 最高價氧化物對應水化物的堿性:
D. 最高價氧化物對應水化物的堿性:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.碘是人體不可缺乏的元素,為了防止碘缺乏,現在市場上流行一種加碘鹽,就是在精鹽中添加一定量的KIO3進去。某研究小組為了檢測某加碘鹽中是否含有碘,查閱了有關的資料,發現其檢測原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)該反應的氧化劑是____;氧化產物與還原產物的物質的量比是___;如果反應生成0.3mol的單質碘,則轉移的電子數目是____。
(2)若采用下圖實驗裝置將四氯化碳和I2的混合溶液分離。
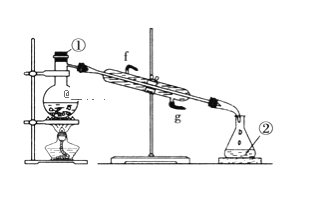
寫出圖中儀器的名稱:①____;該裝置還缺少的儀器是__;冷凝管的進水口是:__(填g或f)。
Ⅱ.我校環保興趣小組在處理污水樣品時,需用質量分數為36.5%的濃鹽酸密度為1.19 g/cm3配制成250mL 0.1mol·L-1的鹽酸溶液。
(1)配制上述溶液除250mL容量瓶、燒杯、膠頭滴管、量筒外還需要的玻璃儀器是___。
(2)根據計算,需要36.5%的濃鹽酸的體積為______mL。
(3)在量取濃鹽酸后,下列操作先后順序是(用編號表示)_______。
① 待稀釋的鹽酸溫度與室溫一致后,沿玻璃棒注入所選定規格的容量瓶中。
② 往容量瓶中小心加蒸餾水至液面接近環形刻度線1~2 cm處,改用膠頭滴管加蒸餾水,使凹液面最低處與瓶頸的環形刻度線相切。
③ 在盛鹽酸的燒杯中注入適量蒸餾水,并用玻璃棒攪動,使其混合均勻。
④ 用蒸餾水洗滌燒杯和玻璃棒2至3次,并將洗滌液全部注入容量瓶。
(4)假設配制時其他操作均正確,只出現以下哪種情況時,會造成所配制的溶液濃度相比于要求的值偏高? (______)
A.容量瓶中有少量蒸餾水
B.定容時仰視容量瓶讀數
C.定容時俯視容量瓶讀數
D.配制的溶液裝入潔凈的但有少量蒸餾水的試劑瓶中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)檸檬 酸是 一種 重 要的 有 機 酸 ,其結構簡式 為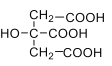 , 其電離常數K1=7.41×10-4,K,2=1.74×10-5,K3=3.98×10-7。碳酸的電離常數K1=4.5×10-7,K1=4.7×10-11。請回答下列有關問題:
, 其電離常數K1=7.41×10-4,K,2=1.74×10-5,K3=3.98×10-7。碳酸的電離常數K1=4.5×10-7,K1=4.7×10-11。請回答下列有關問題:
①設計實驗證明檸檬酸的酸性比碳酸強:___。
②設計實驗證明檸檬酸為三元酸:___。
(2)綠色電源“二甲醚-氧氣燃料電池”的工作原理如圖所示。
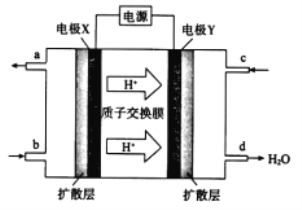
①氧氣應從 c 處通入,則電極 Y 上發生反應的電極反應式為___。
②二甲醚(CH3OCH 3 )應從 b 處通入,則電極 X上發生反應的電極反應式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知氯氣通入熱的苛性鈉溶液中會發生如下反應:3Cl2+6NaOH=5NaCl+NaClO3+3H2O反應中還原劑是___(填化學式);把此反應改寫成離子方程式:___;
(2)用“雙線橋”表示下列氧化還原反應中電子轉移的方向和數目:3Cl2+6NaOH=5NaCl +NaClO3+3H2O。___
(3)若生成1mol的NaClO3,轉移的電子數是___;若反應中轉移了2.5mol的電子,則消耗標況下Cl2的體積是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在三個容積均為![]() 的恒容密閉容器中按不同方式投入反應物,發生反應
的恒容密閉容器中按不同方式投入反應物,發生反應![]()
![]() ,測得反應的相關數據如下:
,測得反應的相關數據如下:
容器 | 容器Ⅰ | 容器Ⅱ | 容器Ⅲ |
反應溫度 | 600 | 600 | 800 |
反應物投入量 |
|
|
|
平衡 |
|
|
|
平衡 |
|
|
|
平衡體系總壓強 |
|
|
|
物質的轉化率 |
|
|
|
平衡常數K |
|
|
|
下列敘述正確的是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組模擬工業制漂白粉,設計了如下圖所示的實驗裝置。
已知:①氯氣與堿反應放出熱量。②6Cl2+6Ca(OH)2=5CaCl2+Ca(ClO3)2+6H2O。
試回答下列問題:
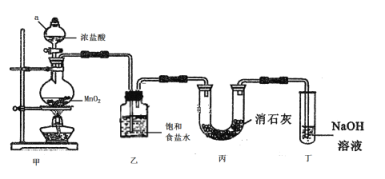
(1)甲裝置中儀器a的名稱是________________________。
(2)裝置乙中飽和食鹽水的作用是________________________。
(3)裝置丁中發生反應的化學方程式為_____________________。
(4)漂白粉在空氣中失效的原因是______________、______________(用化學方程式表示)。
(5)①該小組制得的漂白粉中n(CaCl2)遠大于n[Ca(ClO)2],其主要原因是________ 。
②為提高Ca(ClO)2的含量。可采取的措施是___________(任寫一種即可)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com