
【題目】X、Y、Z、W為四種短周期主族元素,且原子序數依次增大。已知X的最外層電子數是其電子層數的2倍,Y是地殼中含量最高的元素,Y原子的最外層電子數是W原子最外層電子數的2倍,Z原子最外層只有1個電子。下列說法正確的是( )
A. 離子半徑:![]() B. Z和Y形成的化合物可能含有非極性鍵
B. Z和Y形成的化合物可能含有非極性鍵
C. 氫化物的穩定性:![]() D. 最高價氧化物對應水化物的堿性:
D. 最高價氧化物對應水化物的堿性:![]()
【答案】B
【解析】
Y是地殼中含量最高的元素,應為O元素,X的最外層電子數是其電子層數的2倍,且原子序數比Y小,應為C元素,Y原子的最外層電子數是W原子最外層電子數的2倍,則W的最外層電子數為3,應為Al,Z原子最外層只有一個電子,且原子序數比W小,比Y大,應為Na元素,結合對應單質、化合物的性質以及元素周期律知識解答該題。
由題述條件知,X是碳元素,Y是氧元素,Z是鈉元素,W是鋁元素。
A、根據電子層相同的離子,核電荷數小半徑大,離子半徑:![]() ,故A錯誤;
,故A錯誤;
B、Z和Y形成的化合物![]() 中含有非極性鍵,故B正確;
中含有非極性鍵,故B正確;
C、同周期氫化物的穩定性從左到右穩定性增強,氫化物穩定性:![]() ,故C錯誤;
,故C錯誤;
D、根據元素的金屬性越強最高價氧化物對應水化物的堿性越強,堿性:![]() ,故D錯誤。
,故D錯誤。
故選B。


科目:高中化學 來源: 題型:
【題目】喹硫平可用于精神疾病的治療,它的合成路線如下:
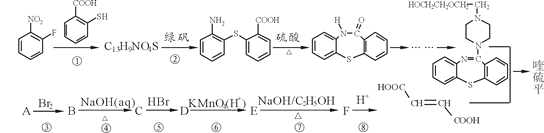
(1)寫出C13H9NO4S中所有含氧官能團的名稱__________。
(2)A屬于烴,且相對分子質量是54,寫出A的結構簡式_______________。
(3)反應①~⑤中屬于取代反應的有____(選填序號)。
寫出反應⑦的化學方程式________________。
(4)流程中設計反應⑤和⑦的目的是_____________________。
(5)物質C的同分異構體有多種,其中既含有羥基,又含有醛基的同分異構體有____種。
(6)已知:苯環上的羧基為間位定位基,如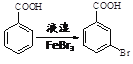 。寫出以
。寫出以![]() 為原料制備
為原料制備 的合成路線流程圖(無機試劑任選,可利用本題中的相關信息)。合成路線流程圖示例如下:
的合成路線流程圖(無機試劑任選,可利用本題中的相關信息)。合成路線流程圖示例如下:![]() 。_____________
。_____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通過海水晾曬可以得到粗鹽,粗鹽除還有NaCl外,還含有MgCl2、 CaCl2、 Na2SO4以及泥沙等雜質。以下是某興趣小組制備精鹽的實驗方案,各步操作流程如下。下列說法正確的是
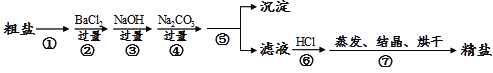
A. 實驗過程中①、⑤步驟的操作分別是溶解、過濾
B. 實驗過程中步驟④的目的是僅除去溶液中的Ca2+
C. 實驗過程中步驟⑦中的蒸發所用到的儀器是酒精燈、玻璃棒、燒杯、鐵架臺(帶鐵圈)
D. 實驗過程中②、④步驟互換,對實驗結果不影響
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】分類是科學研究的重要方法,下列物質分類正確的是( )
A. 非電解質:乙醇、氯氣B. 酸性氧化物:NO、![]()
C. 膠體:豆漿、葡萄糖溶液D. 離子化合物:NaH、![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,向一定體積 0.1mol/L 醋酸溶液中逐滴加入等濃度的 NaOH 溶液,溶液中pOH 與 pH 的變化關系如圖所示,則正確的是( )
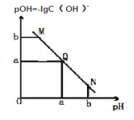
A. M 點所示溶液導電能力強于 Q 點
B. N 點所示溶液中 c(Na+)>c(CH3COO-)
C. Q 點所示的溶液 pH 一定等于 7
D. Q 點加入 NaOH 溶液的體積等于醋酸溶液的體積
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用硫酸渣(主要含![]() 、FeO,雜質為
、FeO,雜質為![]() 和
和![]() 等)生產鐵基顏料鐵黃(FeOOH)的制備流程如下:
等)生產鐵基顏料鐵黃(FeOOH)的制備流程如下:

(1)FeOOH中Fe元素的化合價為____。
(2)“酸溶”時,所選擇的硫酸為溶質質量分數49%,密度![]() ,該硫酸物質的量濃度是___
,該硫酸物質的量濃度是___![]() ,
,![]() 反應的離子方程式為____。
反應的離子方程式為____。
(3)濾渣Ⅰ的主要成分是![]() 和___(填化學式);
和___(填化學式);![]() 被
被![]() 還原的離子方程式為_____。
還原的離子方程式為_____。
(4)“氧化”中,需檢驗溶液中的離子是否氧化完全,所選用的試劑是____。
(5)濾液Ⅱ中溶質是___(填化學式);洗滌固體的操作是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與人類文明進步息息相關,下列說法錯誤的是( )
A. 蠶絲的主要成分是蛋白質,屬于天然高分子材料
B. 漢代燒制出“明如鏡、聲如磬”的瓷器,主要化學成分是硅酸鹽
C. 2022年冬奧會聚氨酯速滑服,是無機非金屬材料
D. 城市公交系統推廣的清潔燃料壓縮天然氣“![]() ”、液化石油氣“
”、液化石油氣“![]() ”,主要成分都是烴
”,主要成分都是烴
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某工業廢水中含有大量FeSO4,較多的Cu2+,極少量的Na+ 以及部分污泥,通過下列流程可從該廢水中回收FeSO4·7H2O晶體及金屬Cu。
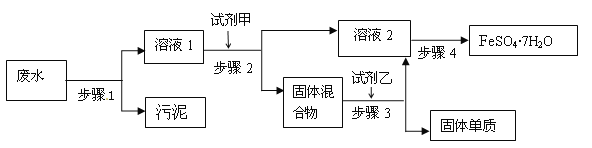
(1)步驟1的主要操作是___,需用到的玻璃儀器除燒杯外還有___。
(2)固體混合物是____(填化學式)
(3)步驟3中發生反應的化學方程式為___。
(4)步驟4中涉及的操作是:蒸發濃縮、___、過濾、洗滌、干燥。
(5)火法制得的粗銅中常混有少量氧化亞銅(Cu2O),氧化亞銅溶于稀硫酸溶液變藍。試寫出該反應的離子方程式___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化鎂![]() 是一種重要的化學試劑。某化學興趣小組擬制備氮化鎂并測定產品純度。
是一種重要的化學試劑。某化學興趣小組擬制備氮化鎂并測定產品純度。
已知:①氮化鎂極易與水反應;②實驗室在加熱條件下用飽和![]() 溶液和飽和
溶液和飽和![]() 溶液混合制備
溶液混合制備![]() ;③焦性沒食子酸溶液用于吸收少量
;③焦性沒食子酸溶液用于吸收少量![]() 。
。
Ⅰ.制備氮化鎂。
他們選擇下列裝置設計實驗(裝置可重復使用):
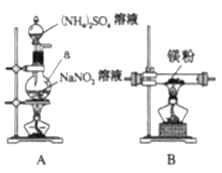
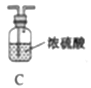

(1)儀器a的名稱是____,氮化鎂的電子式是____。
(2)氣體從左至右,裝置連接順序為____。(填代號)
(3)寫出A中發生反應的化學方程式:____。
(4)用化學方法檢驗產品中含有氮化鎂![]() ,設計實驗方案:____。
,設計實驗方案:____。
Ⅱ.測定產品純度。
利用如圖裝置測定氮化鎂產品純度(雜質不產生氣體,氨氣不溶于煤油)。

(5)當產品與蒸餾水完全反應后,冷卻至室溫、調平液面、讀數。調平液面的操作是__。
(6)取產品質量為wg,開始量氣管讀數為![]() ,最終量氣管讀數為
,最終量氣管讀數為![]() (折合成標準狀況),則該樣品純度為____(用代數式表示)。如果開始俯視刻度線,終點時仰視刻度線,則測得結果___(填“偏高”“偏低”或“無影響”)。
(折合成標準狀況),則該樣品純度為____(用代數式表示)。如果開始俯視刻度線,終點時仰視刻度線,則測得結果___(填“偏高”“偏低”或“無影響”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com