

分析 (1)化學平衡常數是指一定溫度下,當一個可逆反應達到化學平衡時,生成物濃度系數之冪的積與反應物濃度系數之冪的積比值,吸附小分子的肌紅蛋白(MbX)的個數等于生成MbX的個數,由K=$\frac{c(MbX)}{c(Mb)\frac{P}{po}}$可得c(Mb)=$\frac{c(MbX)}{K\frac{P}{po}}$,吸附小分子的肌紅蛋白(MbX)占總肌紅蛋白的比例等于$\frac{c(MbX)}{c(Mb)+c(MbX)}$=$\frac{c(MbX)}{\frac{c(MbX)}{K\frac{P}{po}}+c(MbX)}$=$\frac{K\frac{P}{po}}{K\frac{P}{po}+1}$;
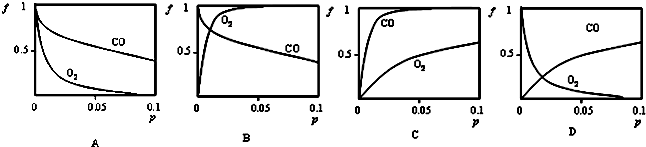
(2)增大壓強,平衡正向移動,因此無論是CO還是O2,隨著壓強的增大,結合率(f)都是逐漸增大.在常溫下,肌紅蛋白與CO結合反應的平衡常數K(CO)遠大于與O2結合的平衡常數K(O2),說明肌紅蛋白與CO的結合能力比其與O2的結合能力強,所以相同壓強條件下,肌紅蛋白與CO的結合率(f)更大;
(3)已知:①Hb(aq)+H+(aq)?HbH+(aq);△H1,K1
②HbH+(aq)+O2(g)?HbHO2(aq)+H+;△H2,K2
由蓋斯定律可知:①+②可得Hb(aq)+O2(g)?HbO2(aq)△H,
因此△H=△H1+△H2,K=K1•K2;
反應Hb(aq)+O2(g)?HbO2(aq),△S<0,由△G=△H3-T•△S<0自發可知,低溫下反應③能自發進行,說明△H3<0;
(4)當pH>7.4時,與PH=7.4時相比,氫離子濃度減小,HbH+(aq)+O2(g)?HbHO2(aq)+H+的化學平衡正向移動,增大了血紅蛋白氧結合率(f);
(5)保持其他條件不變,在t2時將容器容積縮小一倍,CO2的濃度瞬間增大,同時壓強增大,平衡正向移動,濃度減小,t3時達到平衡,平衡時濃度比原來大,t4時降低溫度,平衡正向移動,濃度減小,t5時達到平衡,平衡時濃度比原來小.
解答 解:(1)Mb(aq)+X(g)?MbX(aq)的化學平衡常數K=$\frac{c(MbX)}{c(Mb)•c(X)}$=$\frac{c(MbX)}{c(Mb)\frac{P}{po}}$;吸附小分子的肌紅蛋白(MbX)的個數等于生成MbX的個數,由K=$\frac{c(MbX)}{c(Mb)\frac{P}{po}}$可得c(Mb)=$\frac{c(MbX)}{K\frac{P}{po}}$,吸附小分子的肌紅蛋白(MbX)占總肌紅蛋白的比例等于$\frac{c(MbX)}{c(Mb)+c(MbX)}$=$\frac{c(MbX)}{\frac{c(MbX)}{K\frac{P}{po}}+c(MbX)}$=$\frac{K\frac{P}{po}}{K\frac{P}{po}+1}$;
故答案為:$\frac{c(MbX)}{c(Mb)\frac{P}{po}}$;$\frac{K\frac{P}{po}}{K\frac{P}{po}+1}$;
(2)對于Mb(aq)+X(g)?MbX(aq),增大壓強,平衡正向移動,因此無論是CO還是O2,隨著壓強的增大,結合率(f)都是逐漸增大.在常溫下,肌紅蛋白與CO結合反應的平衡常數K(CO)遠大于與O2結合的平衡常數K(O2),說明肌紅蛋白與CO的結合能力比其與O2的結合能力強,所以相同壓強條件下,肌紅蛋白與CO的結合率(f)更大,因此C圖象符合,
故選C;
(3)已知:①Hb(aq)+H+(aq)?HbH+(aq);△H1,K1
②HbH+(aq)+O2(g)?HbHO2(aq)+H+;△H2,K2
由蓋斯定律可知:①+②可得Hb(aq)+O2(g)?HbO2(aq)△H,
因此△H=△H1+△H2,K=K1•K2;
反應Hb(aq)+O2(g)?HbO2(aq),△S<0,由△G=△H3-T•△S<0自發可知,低溫下反應③能自發進行,說明△H3<0;
故答案為:△H1+△H2;K1•K2;<;<;
(4)當pH>7.4時,與PH=7.4時相比,氫離子濃度減小,HbH+(aq)+O2(g)?HbHO2(aq)+H+的化學平衡正向移動,增大了血紅蛋白氧結合率(f),因此A曲線符合;
故答案為:A;
(5)保持其他條件不變,在t2時將容器容積縮小一倍,CO2的濃度瞬間增大,同時壓強增大,平衡正向移動,濃度減小,t3時達到平衡,平衡時濃度比原來大,t4時降低溫度,平衡正向移動,濃度減小,t5時達到平衡,平衡時濃度比原來小,則t2~t6CO2的濃度隨時間的變化如圖: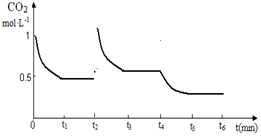 ,故答案為:
,故答案為: .
.
點評 本題考查了化學平衡常數的計算、化學平衡的移動、反應熱的計算、化學反應進行的方向等問題,綜合性很強,難度較大,題干素材涉及生物知識,很好的考查了學生化學反應原理的掌握水平.


科目:高中化學 來源: 題型:選擇題
| A. | NH4Cl的電子式: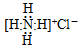 | |
| B. | 對硝基甲苯: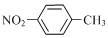 | |
| C. | 碳酸的電離方程式:H2CO3?2H++CO${\;}_{3}^{2-}$ | |
| D. | 硫離子的結構示意圖: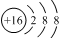 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
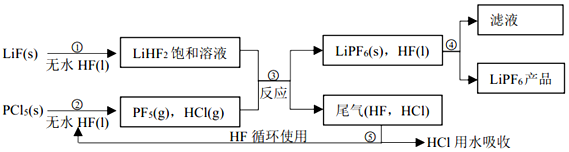
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④⑥ | B. | ①③④⑤⑥ | C. | ②③⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 物質 | CH4 | CO2 | CO | H2 |
| 體積分數 | 0.1 | 0.1 | 0.4 | 0.4 |

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
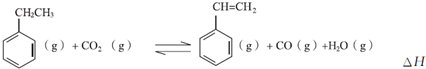
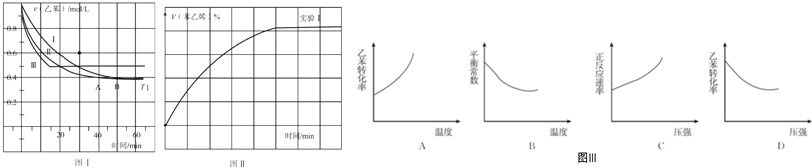

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Al(OH)3是某些胃藥的一種成分 | |
| B. | 乳酸鐵是某些補鐵口服液的有效成分 | |
| C. | 臭氧可以作為新型自來水消毒劑 | |
| D. | SO2常用作紅葡萄酒中殺菌消毒劑 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com