
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-Q1kJ/mol CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(g)△H=-Q2kJ/mol | |
| B. | S(s)+O2(g)═SO2(g)△H=-Q1kJ/mol S(g)+O2(g)═SO2(g)△H=-Q2kJ/mol | |
| C. | H2(g)+Cl2(g)═2HCl(g)△H=-Q1kJ/mol H2(g)+Br2(g)═2HBr(g)△H=-Q2kJ/mol | |
| D. | HCl(aq)+NaOH(aq)═+NaCl(aq)+H2O(I)△H=-Q1kJ/mol CH3COOH(aq)+NaOH(aq)═CH3COOHNa(aq)+H2O(l)△H=-Q2kJ/mol |
分析 A.等量物質完全燃燒放出的熱量多;
B.等量物質氣態時具有的能量多;
C.Cl2比Br2活潑,Cl-Cl鍵能較大,放出的熱量更多;
D.弱酸電離時要吸收熱量.
解答 解:A.等量物質完全燃燒放出的熱量多,則甲烷完全燃燒生成二氧化碳時放出的熱量多,即Q1>Q2,故A錯誤;
B.等量物質氣態時具有的能量多,則氣態硫具有的能量多,所以燃燒后氣態硫放出的熱量多,即Q1<Q2,故B正確;
C.Cl2比Br2活潑,Cl-Cl鍵能較大,則氯氣與氫氣反應放出的熱量更多,所以Q1>Q2,故C錯誤;
D.弱酸電離時要吸收熱量,醋酸與氫氧化鈉反應生成1mol水放出熱量小于57.3kJ,而鹽酸與氫氧化鈉反應生成1mol水放出熱量為57.3kJ,所以Q1>Q2,故D錯誤.
故選B.
點評 本題考查了反應熱大小比較,注意根據物質的狀態、物質的穩定性來判斷反應放熱多少,題目難度不大.


科目:高中化學 來源: 題型:解答題
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 ,硒(Se)是人體必需的微量元素,與⑧同一主族且比⑧原子多一個電子層,則Se的原子序數為34.
,硒(Se)是人體必需的微量元素,與⑧同一主族且比⑧原子多一個電子層,則Se的原子序數為34.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
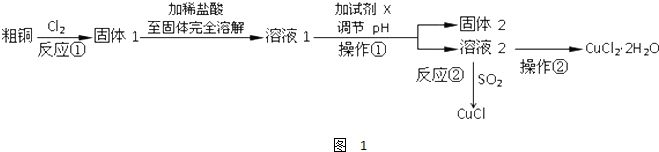

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ClO3-的空間構型為平面三角形 | |
| B. | SiF4 和 SO32-的中心原子均為 sp3 雜化 | |
| C. | 在所有的元素中,氟的第一電離能最大 | |
| D. | C2H5OH 分子中共含有 8 個極性鍵,1 個 π 鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | c(H+) | B. | H+個數 | C. | CH3COOH分子數 | D. | c(H+)/c(CH3COOH) |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
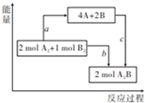 已知25℃、101kPa下,斷開1molA-A、1molB-B、1molA-B鍵時需要吸收436kJ、498kJ、463kJ的能量,如圖是相同條件下,反應2A2+B2$\frac{\underline{\;點燃\;}}{\;}$2A2B的能量關系圖.下列說法中產物的是( )
已知25℃、101kPa下,斷開1molA-A、1molB-B、1molA-B鍵時需要吸收436kJ、498kJ、463kJ的能量,如圖是相同條件下,反應2A2+B2$\frac{\underline{\;點燃\;}}{\;}$2A2B的能量關系圖.下列說法中產物的是( )| A. | a=1370kJ | |
| B. | 該反應是吸熱反應 | |
| C. | A、B原子更易結合生成A2B | |
| D. | 反應的能量轉化形式,由化學能轉化為熱能 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
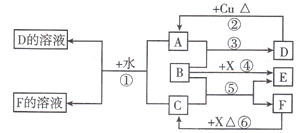
 .根據圖中信息,B、C、X的氧化性由強到弱的順序是MnO2>Cl2>H2O2(用化學式表示).
.根據圖中信息,B、C、X的氧化性由強到弱的順序是MnO2>Cl2>H2O2(用化學式表示).查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com