

分析 (1)根據碳酸鈣、碳酸鋇與鹽酸的反應可知,碳酸鍶與鹽酸反應生成氯化鍶、水、二氧化碳.碳酸鍶不溶于水,氯化鍶易溶于水;
(2)①②加入少量30% H2O2溶液目的是除去亞鐵離子,反應要在酸性溶液中進行;
③調節pH除去Fe3+等,不能引入雜質;
(3)①氯化鍶晶體在氯化鍶飽和溶液中的溶解度較小;
②由題中信息可知,當高于61℃時晶體會失去結晶水,故熱風吹干六水氯化鍶時溫度應低于61℃;
(5)根據題中信息,硫酸鍶能生成碳酸鍶,說明碳酸鍶的溶解度小于硫酸鍶,根據元素守恒和電荷守恒書寫反應的離子方程式.
解答 解:(1)碳酸鍶與鹽酸反應生成氯化鍶、水、二氧化碳.碳酸鍶不溶于水,氯化鍶易溶于水.反應離子方程式為:SrCO3+2H+═Sr2++H2O+CO2↑,
故答案為:SrCO3+2H+═Sr2++H2O+CO2↑;
(2)加入少量30% H2O2溶液目的是除去亞鐵離子,反應要在酸性條件下進行,所以
①A溶液的溶質是H2SO4,
故答案為:H2SO4;
②30% H2O2溶液能將Fe2+氧化到Fe3+,
故答案為:使Fe2+氧化到Fe3+;
③調節pH除去Fe3+等,要不能引入雜質,最好選用氫氧化鍶粉末或氧化鍶粉末;
故答案為:BD;
(3)①氯化鍶晶體在氯化鍶飽和溶液中的溶解度較小,洗滌氯化鍶晶體選用氯化鍶飽和溶液,既溶解晶體表面附著的雜質,又減少洗滌時氯化鍶因溶解造成的損失,
故答案為:既溶解晶體表面附著的雜質,又減少洗滌時氯化鍶因溶解造成的損失;
②由題中信息可知,當高于61℃時晶體會失去結晶水,故熱風吹干六水氯化鍶時溫度應低于61℃,
故答案為:A;
(4)工天青石(主要成分為硫酸鍶,含不溶性雜質)與碳酸鈉溶液的混合物在90℃時加熱1~2h,經過濾、洗滌,得到碳酸鍶,根據元素守恒和電荷守恒可知該反應的離子方程式為SrSO4+CO32-=SrCO3+SO42-,
故答案為:SrSO4+CO32-=SrCO3+SO42-.
點評 本題以氯化鍶的制備為載體,考查學生對工藝流程的理解、元素周期律、物質的分離提純、沉淀轉化等,綜合性較強,涉及的知識點多,難度中等,需要學生具備閱讀分析能力和靈活運用知識的解決問題能力.


 百年學典課時學練測系列答案
百年學典課時學練測系列答案科目:高中化學 來源: 題型:選擇題
| A. | A、E一定在不同周期 | |
| B. | D在第二周期 | |
| C. | A、D可能在同一主族 | |
| D. | C、D的單質可能化合形成離子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 汽油和水,四氯化碳和水 | B. | 汽油和水,苯和水 | ||
| C. | 食用油和水,醋酸和水 | D. | 葡萄糖和水,酒精和水 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 Ⅱ
Ⅱ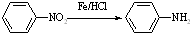 (苯胺,易被氧化)
(苯胺,易被氧化) ;
; +2NaOH→
+2NaOH→ +HCOONa+H2O.
+HCOONa+H2O.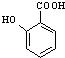 有多種同分異構體,其中含符合下列條件的共有2種.
有多種同分異構體,其中含符合下列條件的共有2種. 的過程.
的過程.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 量取10mL該溶液倒入試管中,試管中,試管中Na+的物質的量為0.08mol | |
| B. | 該溶液的物質的量濃度為0.8mol•L-1 | |
| C. | 該溶液中含有46.8g NaCl | |
| D. | 配置50mL該溶液需用23.4g NaCl |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 二氯化二硫(S2Cl2)在工業上用于橡膠的硫化,它極易與水反應.為在實驗室合成S2Cl2,某化學研究性學習小組查閱有關資料,有如下兩種反應原理:
二氯化二硫(S2Cl2)在工業上用于橡膠的硫化,它極易與水反應.為在實驗室合成S2Cl2,某化學研究性學習小組查閱有關資料,有如下兩種反應原理:| 物質 | S | CS2 | CCl4 | S2Cl2 |
| 沸點/℃ | 445 | 47 | 77 | 137 |
| 熔點/℃ | 113 | -109 | -23 | -77 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | CH3OH | CH3OCH3 | H2O |
| 濃度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 升高溫度,可使①②③④反應速率均加快 | |
| B. | △H3=-110.5kJ.mol-1,△H4=+172.5kJ.mol-1 | |
| C. | 反應①②③④均屬于化合反應、氧化還原反應 | |
| D. | CO的燃燒熱是566.0kJ.mol-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com