
【題目】姜黃素是一種天然染料,工業上可用石油的裂解產物通過如圖反應制得:
已知:![]()
![]() CH3CHO+
CH3CHO+![]()
![]()
![]() +H2O
+H2O
請回答下列問題:
![]() 試劑X為 ______ ;
試劑X為 ______ ;
![]() 最多能消耗Na、NaOH、
最多能消耗Na、NaOH、![]() 的物質的量分別為3mo1、2mol、1mol,則E的結構簡式為 ______ ;
的物質的量分別為3mo1、2mol、1mol,則E的結構簡式為 ______ ;
![]() 姜黃素中的含氧官能團除甲氧基
姜黃素中的含氧官能團除甲氧基![]() 外還有 ______
外還有 ______ ![]() 寫名稱
寫名稱![]() ;
;
![]() 反應
反應![]() 的化學方程式為 ______ ,其反應類型是 ______ ;
的化學方程式為 ______ ,其反應類型是 ______ ;
![]() 符合下列條件G的同分異構體共有 ______ 種,其中核磁共振氫譜中有5組峰,且面積比為2:2:2:1:1的是 ______ ;
符合下列條件G的同分異構體共有 ______ 種,其中核磁共振氫譜中有5組峰,且面積比為2:2:2:1:1的是 ______ ;
①屬于芳香酯類 ②苯環上有兩個取代基 ③能與![]() 溶液發生顯色反應
溶液發生顯色反應
![]() 借鑒制取姜黃素的方法也能合成肉桂醛(
借鑒制取姜黃素的方法也能合成肉桂醛(![]() ),寫出制備肉桂醛所需有機物的結構簡式 ______ 。
),寫出制備肉桂醛所需有機物的結構簡式 ______ 。
【答案】NaOH的水溶液 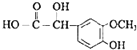 羥基、羰基
羥基、羰基 ![]() 氧化反應 9
氧化反應 9 ![]()
![]() 、
、![]()
【解析】
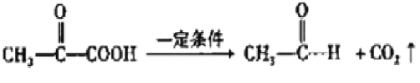
乙烯和溴發生加成反應生成A為BrCH2CH2Br,由A→D的系列轉化及C、D分子式可知,C中醛基氧化生成D,則A在氫氧化鈉水溶液、加熱條件下發生水解反應生成B為HOCH2CH2OH,B發生催化氧化生成C為OHC-CHO,C中部分醛基被氧化生成D為OHC-COOH,1molE最多能消耗Na、NaOH、NaHCO3的物質的量分別為3mo1、2mol、1mol,結合F的結構可知,D中醛基發生加成生成E為 ,E中的醛基被氧化生成F,F在一定條件下發生信息i中脫羧反應生成G為
,E中的醛基被氧化生成F,F在一定條件下發生信息i中脫羧反應生成G為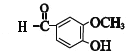 ,結合信息ii及姜黃素的分子式,可知姜黃素的結構簡式為:
,結合信息ii及姜黃素的分子式,可知姜黃素的結構簡式為: 。
。
(1)A→B發生鹵代烴的水解反應,試劑X為NaOH的水溶液,
故答案為:NaOH的水溶液;
(2)E的結構簡式為: ,
,
故答案為: ;
;
(3)姜黃素的結構簡式為: ,姜黃素中的含氧官能團除甲氧基(CH3O)外還有:羥基、羰基,
,姜黃素中的含氧官能團除甲氧基(CH3O)外還有:羥基、羰基,
故答案為:羥基、羰基;
(4)反應B→C的化學方程式為:![]() ,屬于氧化反應,
,屬于氧化反應,
故答案為:![]() ;氧化反應;
;氧化反應;
(5)G(
![]() 的同分異構體符合條件:①屬于芳香族酯類,②苯環上有兩個取代基,③能與FeCl3溶液發生顯色反應,說明含有酚羥基,所以苯環上除酚羥基之外,另一取代基可能的結構有-OOCCH3、-COOCH3、-CH2OOCH,均有鄰、間、對3種,所以符合條件的香蘭醛的同分異構體共有9種,其中核磁共振氫譜中有5組峰,且面積比為2:2:2:1:1的是
的同分異構體符合條件:①屬于芳香族酯類,②苯環上有兩個取代基,③能與FeCl3溶液發生顯色反應,說明含有酚羥基,所以苯環上除酚羥基之外,另一取代基可能的結構有-OOCCH3、-COOCH3、-CH2OOCH,均有鄰、間、對3種,所以符合條件的香蘭醛的同分異構體共有9種,其中核磁共振氫譜中有5組峰,且面積比為2:2:2:1:1的是![]() ,
,
故答案為:9;![]() ;
;
(6)借鑒制取姜黃素的方法也能合成肉桂醛![]()
![]()
![]() ,制備肉桂醛所需有機物的結構簡式為
,制備肉桂醛所需有機物的結構簡式為![]() 、CH3CHO,
、CH3CHO,
故答案為:![]() 、CH3CHO。
、CH3CHO。


 津橋教育計算小狀元系列答案
津橋教育計算小狀元系列答案科目:高中化學 來源: 題型:
【題目】H2S在金屬離子的鑒定分析、煤化工等領域都有重要應用。請回答:
Ⅰ.工業上一種制備H2S的方法是在催化劑、高溫條件下,用天然氣與SO2反應,同時生成兩種能參與大氣循環的氧化物。
(1)該反應的化學方程式為_____________。
Ⅱ.H2S可用于檢測和沉淀金屬陽離子。
(2)H2S的第一步電離方程式為________。
(3)已知:25 ℃時,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。該溫度下,向濃度均為0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,當Sn2+開始沉淀時,溶液中c(Cd2+)=________(溶液體積變化忽略不計)。
Ⅲ.H2S是煤化工原料氣脫硫過程的重要中間體。反應原理為
ⅰ.COS(g)+H2(g) ![]() H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
(4)已知:斷裂1 mol分子中的化學鍵所需吸收的能量如表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/(kJ·mol-1) | 1 319 | 442 | x | 678 | 930 | 1 606 |
表中x=________。
(5)向10 L容積不變的密閉容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),進行上述兩個反應。其他條件不變時,體系內CO的平衡體積分數與溫度(T)的關系如圖所示。
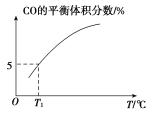
①隨著溫度升高,CO的平衡體積分數_____(填“增大”或“減小”)。原因為_______
②T1℃時,測得平衡時體系中COS的物質的量為0.80 mol。則該溫度下,COS的平衡轉化率為_____;反應ⅰ的平衡常數為_____(保留兩位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用已知物質的量濃度的HCl來測定未知物質的量濃度的NaOH溶液時,選甲基橙作指示劑,使所測氫氧化鈉溶液的濃度偏低的是( )
A.錐形瓶用蒸餾水沖洗后未用待測液潤洗
B.讀取鹽酸體積時,開始仰視讀數,滴定結束時俯視讀數
C.終點時,有一滴標準液掛在滴定管尖嘴處未滴入錐形瓶
D.裝標準液的滴定管滴定前尖嘴處有氣泡,滴定后氣泡消失
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W四種元素的部分信息如下表所示。
元素 | X | Y | Z | W |
相關 信息 | 短周期元素,最高化合價為+7價 | 基態原子中,電子占據的最高能層符號為L,最高能級上只有兩個自旋方向相同的電子 | 核外電子共有15種運動狀態 | 能與X形成兩種常見化合物WX2、WX3,酚遇WX3溶液能發生顯色反應 |
回答下列問題:
(1)W的基態原子電子排布式為___,X、Y、Z三種元素電負性由大到小的順序為___(用具體的元素符號填寫)。
(2)化合物YX4、ZX3、ZX5(氣態或液態時)中,中心原子的軌道類型不是sp3雜化的是___ (填化學式,下同),分子構型是正四面體的是___,ZX3屬于___(極性分子、非極性分子)。
(3)已知WX3的熔點:306℃,沸點:319℃,則WX3的晶體類型為___。
(4)Z原子的價電子軌道表示式為___。
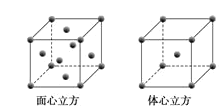
(5)W元素的單質晶體在不同溫度下有兩種堆積方式,晶胞分別如圖所示。在面心立方晶胞中W原子的配位數為___;若W的原子半徑為rcm,阿伏加德羅常數為NA,則其體心立方晶體的密度可表示為___gcm-3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】冰晶胞中水分子的空間排列方式與金剛石晶胞(其晶胞結構如圖,其中空心球所示原子位于立方體的頂點及面心,實心球所示原子位于立方體內)類似。有關冰晶胞的說法合理的是

A.冰晶胞內水分子間以共價鍵相結合
B.晶體冰與金剛石晶體硬度都很大
C.冰分子間的氫鍵具有方向性和飽和性,也是一種σ鍵
D.氫鍵的存在導致冰晶胞與金剛石晶胞微粒的排列方式類似
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反應機理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反應機理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有關該反應的說法正確的是( )
A. 該反應的速率主要取決于①的快慢
B. NOBr2是該反應的催化劑
C. 正反應的活化能比逆反應的活化能小a kJ·mol-1
D. 增大Br2(g)濃度能增大活化分子百分數, 加快反應速率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述相符的是
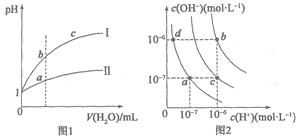
A.圖1表示相同溫度下pH=1的鹽酸和醋酸溶液分別加水稀釋時pH的變化曲線,其中曲線II為鹽酸,且b點溶液的導電性比a點強
B.圖1中,中和等體積的兩種酸,消耗等濃度的NaOH溶液體積V(I)>V(II)
C.圖2中純水僅升高溫度,就可以從a點變到c點
D.圖2中在b點對應溫度下,將pH=2的H2SO4與pH=10的NaOH溶液等體積混合后,溶液顯中性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從海帶中提取碘,可經過以下實驗步驟完成。下列有關說法正確的是( )

A.灼燒過程中使用的玻璃儀器有酒精燈、燒杯、玻璃棒
B.氧化過程中發生反應的離子方程式為![]()
C.檢驗碘單質時,可選用淀粉,若淀粉變藍說明海帶中一定含有碘單質
D.分液時,先打開活塞放出下層液體,再關閉活塞,從上口倒出上層液體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常見有機物間的轉化關系如圖所示(以下變化中,某些反應條件及產物未標明)。A是天然有機高分子化合物,D是一種重要的化工原料。在相同條件下,G蒸氣密度是氫氣的44倍。
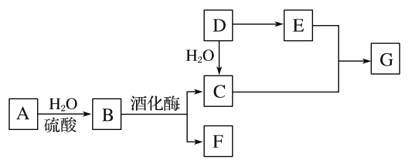
(1)D中官能團的名稱:______________________________________。
(2)C和E反應的化學方程式:________________________。
(3)檢驗A轉化過程中有B生成,先中和水解液,再需要加入的試劑是________________________________。
(4)某烴X的相對分子質量是D、F之和,分子中碳與氫的質量之比是5∶1。下列說法正確的是________(填字母)。
A.X 不溶于水,與甲烷互為同系物
B.X性質穩定,高溫下不會分解
C.X不存在含有3個甲基的同分異構體
D.X可能和溴水發生加成反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com