
【題目】鐵、鈷、鎳的性質非常相似,它們的化合物應用十分廣泛。回答下列問題:
(1)基態鐵原子的價電子排布式為__________。鐵、鈷、鎳的基態原子核外未成對電子數最多的是________。
(2)CoCl2溶于氨水并通入空氣,可從溶液中結晶出橙黃色的[Co(NH3)6]Cl3晶體。該配合物中中心離子是_________,配體分子的價層電子對互斥模型________。
(3)鐵、鎳易與CO作用形成羰基配合物Fe(CO)5、Ni(CO)4,Fe(CO)5的熔點為253K,沸點為376K,則Ni(CO)4固體屬于晶體____________,1mol Ni(CO)4含有的配位鍵數目為_______。
(4)NiO、FeO的晶體結構類型與氯化鈉的相同,Ni2+和Fe2+的離子半徑分別為69pm和78 pm,則熔點NiO__________FeO(填“>”“<”或“=”),原因是_____________。
(5)Fe3O4晶體中,O2-的重復排列方式如圖所示,該排列方式中存在著由如1、3、6、7的O2-圍成的正四面體空隙和3、6、7、8、9、12的O2-圍成的正八面體空隙。Fe3O4中有一半的Fe3+填充在正四面體空隙中,另一半Fe3+和Fe2+填充在正八面體空隙中,則Fe3O4晶體中,正四面體空隙數與O2-數之比為___________,有___________%的正八面體空隙沒有填充陽離子。Fe3O4晶胞中有8個圖示結構單元,晶體密度為5.18g/cm3,則該晶胞參數a= _______________pm。(寫出計算表達式)

【答案】 )3d64s2 鐵(或Fe) Co3+ 四面體形 分子 8NA > 相同電荷的離子,半徑越小,離子間的靜電作用力越大,離子晶體的晶格能越大 2∶1 50% 
【解析】(1)本題考查價電子、電子排布式,Fe原子位于第四周期VIII族,其價電子包括最外層電子和次外層d能級,鐵原子價電子排布式為3d64s2;鐵原子、鈷原子、鎳原子屬于同一族,且最外層s能級上都有2個電子,d能級有5個原子軌道,最多容納10個電子,鐵原子未成對電子數為4,鈷原子未成對電子數為3,鎳原子未成對電子數為2,因此未成對電子數最多的是Fe;(2)考查配位化合物,Co3+為配合物的中心離子,配體是NH3,中心原子為N,價層電子對數為3+(5-3)/2=4,因此價層電子對互斥模型為四面體;(3)本題考查晶體的判斷、配位鍵,Ni(CO)4熔沸點較低,符合分子晶體的特點,因此Ni(CO)4屬于分子晶體,Ni和CO之間存在配位鍵,配位數為4,則1molNi(CO)4中Ni和CO中存在4mol配位鍵,CO和N2互為等電子體,C和O之間存在叁鍵,即存在1個配位鍵,因此1molNi(CO)4中存在配位鍵的個數為8NA;(4)考查離子晶體熔沸點高低的判斷,離子晶體熔沸點與晶格能有關,晶格能越大,熔沸點越高,晶格能與離子所帶電荷數和離子半徑有關,NiO和FeO中離子所帶電荷數相等,但Ni2+的半徑小于Fe2+的半徑,因此NiO的晶格能比FeO大,即NiO的熔點高于FeO;(5)本題考查晶胞,根據信息,此結構中含有8個正四面體,O2-位于頂點和面心,個數為8×1/8+6×1/2=4,因此正四面體和O2-數之比為8:4=2:1;1、6、7、10能夠成1/4的正八面體,即有12個1/4的正八面體,因此此結構中有4個正四面體,Fe3O4中有2個Fe3+和1個Fe2+,因此有兩個正八面體沒有被填充,即50%的正八面體空隙沒有填充陽離子;一個這樣的結構中有4個O2-,而Fe3O4晶胞中有8個圖示結構單元組成,因此晶胞的質量為 g,晶胞的體積為(a×10-10)3cm3,代入密度的表達式,求出a=
g,晶胞的體積為(a×10-10)3cm3,代入密度的表達式,求出a= 。
。


科目:高中化學 來源: 題型:
【題目】已知:25℃、l0lkPa條件下
4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2834.9kJ/mol
4Al(s)+2O3(g)=2Al2O3(s) ΔH=-3119.91kJ/mol: 由此得出的結論正確的是
A. 等質量的O2比O3能量低,由O2變O3為吸熱反應
B. 等質量的O2比O3能量低,由O2變O3為放熱反應
C. O3比O2穩定,由O2變O3為吸熱反應
D. O2比O3穩定,由O2變O3為放熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在濃硝酸中放入銅片:
(1)開始反應的化學方程式為 , 實驗現象為 .
(2)若銅有剩余,則反應將要結束時的反應方程式為 .
(3)待反應停止后,再加入少量25%的稀硫酸,這時銅片上又有氣泡產生,其原因是 .
(4)若將12.8g銅跟一定量的濃硝酸反應,銅消耗完時,共產生5.6L(標準狀況)氣體.則所消耗的HNO3的物質的量為 , 其中顯氧化性的硝酸的物質的量為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W是四種常見的短周期主族元素,其原子半徑隨原子序數的變化如圖所示. 已知Y、Z兩種元素的單質是空氣的主要成分,W原子的最外層電子數與Ne原子的最外層電子數相差l.下列說法正確的是( ) 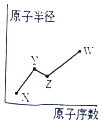
A.Y、Z、W處于同一周期
B.X、Y、Z、W的原子序數遞增
C.X、W可形成化學式為XW的離子化合物
D.簡單離子半徑是Z大于W
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水中有取之不盡的化學資源,從海水中可提取多種化工原料,如圖是某化工廠對海水資源綜合利用的示意圖: 
試回答下列問題:
(1)實驗室里將粗鹽制成精鹽的過程中,過濾的操作需用到玻璃棒,玻璃棒的作用是: , 還需要的玻璃儀器有: .
(2)粗鹽中含有Ca2+、Mg2+、SO42﹣等雜質,精制后可得NaCl飽和溶液,精制時通常在溶液中:①加入過量的BaC12溶液,②過量的NaOH溶液,③過量的Na2CO3溶液,則添加試劑順序為(填寫序號),最后在濾液加入鹽酸至溶液呈中性.請寫出加入鹽酸后可能發生反應的離子方程式: .
(3)海水提取食鹽后的母液中有K+、Na+、Mg2+等陽離子.從離子反應的角度考慮,在母液里加入石灰乳發生反應的離子方程式: .
(4)電解無水氯化鎂制取鎂的化學方程式為 . 將鎂蒸氣冷卻后即為固體鎂,鎂蒸氣需在Ar氣氛圍中冷卻,理由: .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】欲除去甲烷氣體中混有的乙烯得到純凈的甲烷,最好依次通過盛有( )試劑的裝置.
A.澄清石灰水、濃H2SO4
B.酸性KMnO4溶液、濃H2SO4
C.溴水、濃H2SO4
D.CCl4、堿石灰
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】抗癇靈(G)具有抗癲癇、抗驚厥、抗抑郁等功效,其合成路線如下圖所示(某些反應條件和副產物已略):

(1)A中含氧官能團名稱是__________;簡述證明A含有該官能團的實驗方法:_________。
(2)若以醛基為母體,則B的系統命名法的名稱為_________;①~⑥的反應中屬于加成反應的是 ___________ (填序號)。
(3)芳香化合物H是C的同分異構體,H的相關信息如下:a.可發生銀鏡反應; b.可與NaHCO3溶液反應生成氣體;c.苯環上的一溴代物有2種,則H的結構簡式為_______________。
(4)寫出反應⑥的化學反應方程式:__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期三種元素X、Y、Z,原子序數依次遞增,它們的最高價氧化物的水化物皆為強酸,下列說法不正確的是( )
A. Y 在自然界中存在游離態 B. 最高正價:X > Y > Z
C. Y 氣態氫化物溶于水呈酸性 D. 非金屬性:Y < Z
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組用堿式碳酸銅[CuCO3·Cu(OH)2]制取銅粉并測定銅粉純度的實驗如下:
步驟1:將一定量的堿式碳酸銅置于燒杯中,向燒杯中加入N2H4的水溶液,邊攪拌邊加熱,有大量的氣體生成和紅色銅析出,將沉淀過濾、低溫干燥得紅色粉末。
步驟2:稱取1.9600 g紅色粉末于燒杯中,緩慢加入足量稀硫酸,邊加熱邊通入氧氣使粉末完全溶解。冷卻,將溶液移入100 mL 容量瓶中,用水稀釋至刻度。
書驟3:準確量取20.00mL的溶液,調節溶液呈弱酸性,向其中加入過量的KI.,充分反應后,以淀粉溶液作指示劑,用0.2000mol/LNa2S2O3標準溶液滴定,滴定終點時共消耗Na2S2O3標準溶液30.00 mL.過程中所發生的反應如下:Cu2++I-![]() CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
(1)步驟1中所發生反應的化學方程式為_________________。
(2)步驟2 中所發生反應的離子方程式為_________________。
(3)步驟3 中加入過量KI的作用是_________________。
(4)若銅粉中雜質不參與步驟3 的反應,通過計算確定紅色粉末中含銅質量分數(寫出計算過程)________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com