
【題目】(15分)按要求回答下列有關問題。
(1)據報道,科學家新研發出一種常溫下催化合成NH3的方法:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)
已知如下信息:
①化合物的生成熱可以表示其相對能量。化學上,規定標準狀況下穩定單質的生成熱為0。幾種物質的生成熱:NH3(g)為mkJ·mol-1,H2O(l)為nkJ·mol-1。
反應的△H=產物的生成熱之和---反應物的生成熱之和
②幾種化學鍵的鍵能數據如下:
![]()
上述反應中,△H=_______kJ·mol-1,H-N鍵的鍵能為_______kJ·mol-1。
(2)二氧化硫在一定條件下可以發生如下反應:
SO2(g)+NO2(g)![]() SO3(g)+NO(g),△H= -42kJ·mol-1,在1L恒容密閉容器中充入SO2(g)和NO2(g),所得實驗數據如下:
SO3(g)+NO(g),△H= -42kJ·mol-1,在1L恒容密閉容器中充入SO2(g)和NO2(g),所得實驗數據如下:
實驗編號 | 溫度 | 起始時物質的量/mol | 平衡時物質的量/mol | |
N(SO2) | N(NO2) | N(NO) | ||
甲 | T1 | 0.80 | 0.20 | 0.18 |
乙 | T2 | 0.20 | 0.80 | 0.16 |
丙 | T3 | 0.20 | 0.30 | a |
①實驗甲中,若2min時測得放出的熱量是4.2kJ,則0~2min時間內,用SO2(g)表示的平均反應速率v(SO2)=_____________________;
②實驗丙中,達到平衡時,NO2的轉化率為____________;
③由表中數據可推知,Tl______T2(填“>”“<’’或“=”);
(3)對反應N2O4(g)![]() 2NO2(g) △H>0 在溫度為Tl、T2時平衡體系中NO2的體積分數隨壓強變化曲線如圖所示,下列說法正確的是__________。
2NO2(g) △H>0 在溫度為Tl、T2時平衡體系中NO2的體積分數隨壓強變化曲線如圖所示,下列說法正確的是__________。

a.A、C兩點的反應速率:A>C
b.A、C兩點氣體的顏色:A深,C淺
c.由狀態A到狀態B,可以用加熱的方法
d.A、C兩點的化學平衡常數:A=C
(4)工業上,采用石墨、鐵棒作為電極,電解除去廢水中的CN-(N為-3價,下同)

①鐵電極應連接直流電源的____________(填寫電極名稱)。
②上述反應方程式配平后“□”內應填寫________;
③陽極上發生的電極反應為2Cl--2e-=Cl2↑和_______________;
【答案】(1)4m-6n(1分) (2a+12b-3c-4m+6n)/12(2分)
(2)①0.05 mol·L-1·min-1(2分) ②![]() ×100%(2分) ③<(2分)
×100%(2分) ③<(2分)
(3)d(2分)
(4)①負極 (1分) ②N2 (1分) ③CN- -2e- +2OH- = CNO- + H2O(2分)
【解析】
試題分析:(1)△H=產物的生成熱之和—反應物的生成熱之和=(4m+0)-(6n+0)=4m-6n;設H-N鍵的鍵能為xkJ·mol-1,△H=反應物的鍵能和—生成物的鍵能和=(2a+12b-12x-3c)=4m-6n,解得:x=(2a+12b-3c-4m+6n)/12;
(2)①實驗甲中,若2min時測得放出的熱量是4.2kJ,則消耗二氧化硫物質的量為![]() =0.1mol,則v(SO2)=
=0.1mol,則v(SO2)=![]() =0.05mol/(L.min);
=0.05mol/(L.min);
②實驗丙中,平衡時NO為amol,則參加反應二氧化氮的物質的量為amol,故二氧化氮的轉化率為![]() ×100%=
×100%=![]() ×100%;
×100%;
③乙實驗平衡時,NO為0.16mol,則:
SO2(g)+NO2(g)![]() SO3(g)+NO(g)
SO3(g)+NO(g)
起始量(mol):0.2 0.8 0 0
變化量(mol):0.16 0.16 0.16 0.16
平衡量(mol):0.04 0.64 0.16 0.16
T2溫度下平衡常數K=![]() =1,同樣可計算出T2溫度下平衡常數K=
=1,同樣可計算出T2溫度下平衡常數K=![]() =2.63,可見正反應為放熱反應,升高溫度平衡逆向移動,平衡常數減小,故T1<T2;
=2.63,可見正反應為放熱反應,升高溫度平衡逆向移動,平衡常數減小,故T1<T2;
(3)a.由圖象可知,A、C兩點都在等溫線上,C的壓強大,則A、C兩點的反應速率:A<C,故a錯誤;b.由圖象可知,A、C兩點都在等溫線上,C的壓強大,與A相比C點平衡向逆反應進行,向逆反應進行是由于減小體積增大壓強,平衡移動的結果降低NO2濃度增大趨勢,但到達平衡仍比原平衡濃度大,平衡時NO2濃度比A的濃度高,NO2為紅棕色氣體,則A、C兩點氣體的顏色:A淺,C深,故b錯誤;c.升高溫度,化學平衡正向移動,NO2的體積分數增大,由圖象可知,A點NO2的體積分數大,則T1<T2,由狀態A到狀態B,可以用降溫的方法,故c錯誤;D.由圖象可知,A、C兩點都在等溫線上,化學平衡不變,故d正確;答案為d。
(4)①根據發生的電極反應,可以知道金屬鐵是陰極,接電源的負極;
②據氧化還原反應的原理,其反應方程式為3Cl2+2CNO-+8OH-═N2+6Cl-+2CO32-+4H2O,故答案為N2;
③陽極發生氧化反應,陽極的電極反應式為:CN--2e-+2OH-═CNO-+H2O和2Cl--2e-═Cl2↑。


科目:高中化學 來源: 題型:
【題目】有機物A可發生如下轉化(方框內物質均為有機物,部分無機產物已略去):

已知: (R、R'可表示烴基或官能團)
(R、R'可表示烴基或官能團)
請回答:
(1)F蒸氣密度是相同條件下H2密度的31倍,且分子中無甲基。已知1 mol F與足量鈉作用產生H2 22.4 L(標準狀況),則F的分子式是__________________。
(2)G與F的相對分子質量之差為4,則G的性質是________(填字母)。
a.可與銀氨溶液反應 b.可與乙酸發生酯化反應
c.可與氫氣發生加成反應 d.1 mol G可與2 mol新制Cu(OH)2發生反應
(3)D能與NaHCO3反應,且兩分子D可以反應得到含有六元環的酯類化合物,E可使溴的四氯化碳溶液褪色,則D→E的化學方程式是_______________________
(4)B的同分異構體較多,寫出一種不含甲基能發生銀鏡反應的同分異構體結構簡式:_________。
(5)A轉化為B和F的化學方程式是_________________________。
(6)某烴分子H的碳原子數小于10,核磁共振氫譜只有一組峰, 在相同條件下也可發生類似B → C的反應并只生成一種有機物I,I的結構簡式: _______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用均滴有酚酞試液和氯化鈉溶液的濾紙分別制作甲、乙兩個裝置。下列描述正確的是( )

A.濾紙上的陰離子都向碳棒遷移
B.a、d兩極的電極反應式相同
C.b、d兩極附近的溶液都變紅
D.c、d兩極均有少量氣體產生
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國環境監測數據顯示,顆粒物(PM2.5等)為霧霾過程中影響空氣質量最顯著的污染物,其主要來源為燃煤、機動車尾氣等。因此,對PM2.5、SO2、NOx等進行研究具有重要意義。請回答下列問題:
Ⅰ.改變煤的利用方式可減少環境污染,通常可將水蒸氣通過紅熱的碳得到水煤氣。
(1)煤氣化過程中產生的有害氣體H2S可用足量的Na2CO3溶液吸收,該反應的離子方程式為
(已知:H2S:Ka1=1.3×10-7,Ka2=7.1×10-15;H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11)
(2)現將不同量的CO(g)和H2O(g)分別通人到體積為2L的恒容密閉容器中發生如下反應:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH,得到兩組數據
CO2(g)+H2(g) ΔH,得到兩組數據
實驗組 | 溫度℃ | 起始量/mol | 平衡量/mol | 達到平衡 所需時間/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
該反應的![]() H 0(填“<”或“>”);若在7500C時,另做一組實驗,在2L的恒容密閉容器中加入lmol CO,3mo1 H2O,2mo1 CO2,5mol H2,則此時正 逆(填“<”,“>”,“=”)。
H 0(填“<”或“>”);若在7500C時,另做一組實驗,在2L的恒容密閉容器中加入lmol CO,3mo1 H2O,2mo1 CO2,5mol H2,則此時正 逆(填“<”,“>”,“=”)。
(3)一定條件下,某密閉容器中已建立A(g)+B(g) ![]() C(g)+D(g)/span> △H>0的化學平衡,其時間速率圖像如圖,下列選項中對于t1時刻采取的可能操作及其平衡移動情況判斷正確的是
C(g)+D(g)/span> △H>0的化學平衡,其時間速率圖像如圖,下列選項中對于t1時刻采取的可能操作及其平衡移動情況判斷正確的是

A.減小壓強,同時升高溫度,平衡正向移動
B.增加A(g)濃度,同時降低溫度,平衡不移動
C.保持容器溫度壓強不變通入稀有氣體,平衡不移動
Ⅱ.壓縮天然氣(CNG)汽車的優點之一是利用催化技術將NOx轉變成無毒的CO2和N2。
①CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H1<0
2N2(g)+CO2(g)+2H2O(g) △H1<0
②CH4(g) +2NO2(g)![]() N2(g) +CO2(g) +2H2O(g) △H2<0
N2(g) +CO2(g) +2H2O(g) △H2<0
(4)收集某汽車尾氣經測量NOx的含量為1.12%(體積分數),若用甲烷將其完全轉化為無害氣體,處理1×104L(標準狀況下)該尾氣需要甲烷30g,則尾氣中V (NO)︰V (NO2)= 。
(5)在不同條件下,NO的分解產物不同。在高壓下,NO(即X)在40℃下分解生成兩種化合物(即Y、Z),體系中各組分物質的量隨時間變化曲線如圖所示。寫出Y和Z的化學式:

(6) 某研究性學習小組,為研究光化學煙霧消長規律,在一煙霧實驗箱中,測得煙霧的主要成分為RH(烴)、NO、NO2、O3、PAN(CH3COOONO2),各種物質的相對濃度隨時間的消失,記錄于右圖,根據圖中數據,下列推論,最不合理的是

A.NO的消失的速率比RH快
B.NO生成NO2
C.RH及NO2可以生成PAN及O3
D.O3生成PAN
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)鋅錳干電池是一種一次電池,外殼為金屬鋅,中間是碳棒,其周圍有碳粉,二氧化錳,氯化鋅和氯化銨等組成的填充物,該電池在放電過程產生MnOOH(難溶于水),回收處理該廢電池可以得到多種化工原料,有關數據下圖所示:
溶解度/(g/100g水)
溫度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列問題:
①普通鋅錳電池放電時發生的主要反應為:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH。該電池中,負極材料主要是________,正極發生的主要反應式是 。
加堿調節溶液pH,使溶液中氫氧根離子濃度達到 mol/L,鐵剛好完全沉淀(離子濃度小于1×10-5mol/L時,即可認為該離子沉淀完全)。繼續加堿調節pH為 ,鋅開始沉淀(假定Zn2+濃度為0.1mol/L)。
(2)在分析化學中常用Na2C2O4晶體(溶液無色)作為基準物質測定KMnO4溶液的濃度。在H2SO4溶液中,反應如下:2MnO+5C2O+16H+![]() 2Mn2+(溶液無色)+10CO2↑+8H2O。
2Mn2+(溶液無色)+10CO2↑+8H2O。
①若將W g Na2C2O4配成100 mL標準溶液,移取20.00 mL置于錐形瓶中,則酸性KMnO4溶液應裝在__________(填“酸式”或“堿式”)滴定管中。本次滴定 選擇指示劑(填“需要”、“不需要”)。判斷滴定達終點的現象是____ ___。
②若滴定管起始讀數和終點讀數如圖所示,則酸性KMnO4的物質的量濃度為_ (填表達式)。
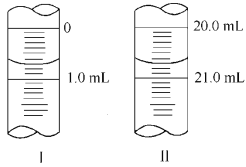
③若滴定完畢立即讀數,測定的KMnO4溶液的濃度___(填“偏高”、“偏低”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】香豆素是用途廣泛的香料,合成香豆素的路線如下(其他試劑、產物及反應條件均省略):

(1)Ⅰ的分子式為_____________;
(2)反應①的反應類型是_____________,反應④的反應類型是_____________。
(3)寫出反應②的化學反應方程式____________ _________。
(4)香豆素在過量NaOH溶液中完全水解的化學方程式為_____________________。
(5)Ⅴ是Ⅳ的同分異構體,Ⅴ的分子中含有苯環且無碳碳雙鍵,苯環上含有兩個鄰位取代基,能發生銀鏡反應。Ⅴ的結構簡式為_______________(任寫兩種)。
(6)一定條件下,![]() 與CH3CHO能發生類似反應①、②的兩步反應,最終生成的有機物的結構簡式為 。
與CH3CHO能發生類似反應①、②的兩步反應,最終生成的有機物的結構簡式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定量的CO2與足量的碳在體積可變的恒壓密閉容器中反應:C(s)+CO2(g)![]() 2CO(g)。平衡時,體系中氣體體積分數與溫度的關系如下圖所示:
2CO(g)。平衡時,體系中氣體體積分數與溫度的關系如下圖所示:

已知:氣體分壓P(分)=氣體總壓P(總)×體積分數。下列說法正確的是( )
A.550℃時,若充入惰性氣體,v(正),v(逆)均減小,平衡不移動
B.650℃時,反應達平衡后CO2的轉化率為25.0%
C.T℃時,若充入等體積的CO2和CO,平衡向逆反應方向移動
D.925℃時,用平衡分壓代替平衡濃度表示的化學平衡常數KP=24.0P(總)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是一種蓄電池的示意圖。被膜隔開的電解質分別為Na2S2和NaBr3,放電后變為Na2S4和NaBr。已知放電時Na+ 由乙池向甲池移動。下面對該裝置工作過程中敘述正確的是

A.放電過程,甲池發生氧化反應
B.放電過程,電池反應:2S22-+ Br3-= S42-+ 3Br-
C.充電過程,乙池為陽極室
D.充電過程,當陽極室陰離子增加2mol,整個電路中電子轉移2mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生利用以下裝置探究氯氣與氨氣之間的反應。其中A、F分別為氨氣和氯氣的發生裝置,C為純凈干燥的氯氣與氨氣反應的裝置。

請回答下列問題:
(1)裝置F中發生反應的離子方程式為_______________________________。
(2)裝置A的燒瓶中可裝試劑_______________________________________________。
(3)B裝置的名稱是_______________________,E裝置的作用______________________________。
(4)通入C裝置的兩根導管左邊較長、右邊較短,目的是_________________________。
(5)裝置C內出現濃厚的白煙并在容器內壁凝結,另一生成物是空氣的主要成分之一。寫出反應的化學方程式: _,該反應中氧化劑和還原劑的物質的量之比為_____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com